题目内容
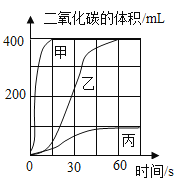
【题目】实验室制备并收集二氧化碳,按下表进行实验。取等质量的同种大理石加入足量酸中(杂质不与酸反应),产生二氧化碳体积随时间变化曲线如图所示。下列说法错误的是
实验编号 | 药品 |
Ⅰ | 块状大理石、10% H2 SO4溶液 |
Ⅱ | 块状大理石、7% HCl溶液 |
Ⅲ | 大理石粉末、7% HCl溶液 |
A.实验Ⅲ对应的左图变化曲线为甲
B.实验II和Ⅲ对比,说明影响反应速率的因素是固体的颗粒大小
C.实验I和Ⅱ对比,说明影响反应速率的因素是酸的浓度
D.实验Ⅱ和Ⅲ完全反应后,产生二氧化碳的质量是相等的
【答案】C
【解析】
块状碳酸钙与稀硫酸反应生成微溶物硫酸钙附在碳酸钙表面,使反应停止;在盐酸浓度相同条件下,粉末状碳酸钙与盐酸反应进行得更快;则实验I、实验II、实验Ⅲ对应曲线分别为丙、乙、甲。
A. 由分析可知,实验Ⅲ对应的左图变化曲线为甲,说法正确;
B. 实验II和Ⅲ对比,盐酸浓度一样,固体形状不同,说明影响反应速率的因素是固体的颗粒大小,说法正确;
C. 实验I和Ⅱ对比,酸的浓度不一样,且酸的种类也不一样,不能说明影响反应速率的因素是酸的浓度,说法错误;
D. 实验Ⅱ和Ⅲ完全反应后,产生二氧化碳的质量是相等的,因为碳酸钙的质量相同,酸足量,说法正确。
故选:C.

【题目】为探究酸的化学性质,某化学小组利用盐酸进行了如下实验操作,请回答:
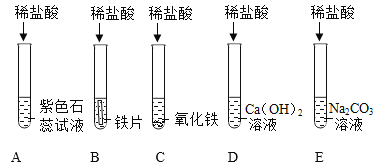
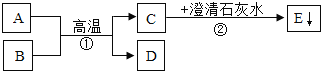
(1)写出C中反应的化学方程式___________________。
(2)装置B中的反应现象:首先观察到__________________,随后观察到___________________,发生反应的化学方程式是___________________。
(3)将反应后D.E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行如下探究:
(提出向题)滤液中溶质的成分是什么?
(作出猜想)
猜想一:NaCl
猜想二:NaC1和CaCl2
猜想三:NaC1、CaCl2和Na2CO3
猜想四:______________(填化学式)
(进行讨论)经过讨论,同学们一致认为猜想____________________是错误的。
(设计实验)请完成实验报告。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量的碳酸钠溶液 | 无明显现象 | 猜想二不成立 |
取少量滤液于试管中,滴加氯化钡溶液 | ________________ | 猜想四成立 |
(4)某工厂化验室用10%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40g,洗涤后的溶液呈中性。计算这些石油产品中含硫酸的质量是多少?___________
【题目】化学课上老师演示在氢氧化钠溶液中滴加稀盐酸实验时,出现了有气泡产生的现象,同学们计划对产生该现象的原因进行探究。
(提出问题)产生的气体成分是什么?
(设计实验)将生成的气体通入澄清的石灰水,石灰水变浑浊。
(分析与讨论)①生成的气体是_____。
②氢氧化钠已变质,变质的原因用化学方程式表示为_____。
(进一步探究)氢氧化钠溶液变质的程度如何?
(实验方案)
方案1:取少量氢氧化钠溶液的样品于一洁净试管中,先滴加酚酞溶液,酚酞变红色,再滴加氯化钙溶液,出现白色沉淀。
方案2:取少量氢氧化钠溶液的样品于一洁净试管中,先滴加澄清石灰水,出现白色沉淀,静置,再在上层溶液中滴加酚酞溶液,酚酞变红色。
(分析与讨论)同学们认为以上两个方案都不正确。
方案1不正确的原因是_____。
方案2不正确的原因是_____。
经过讨论同学设计了以下方案,得到了合理的结论。
实验步骤 | 实验现象 | 实验结论 |
(1)取少量氢氧化钠溶液的样品于一洁净试管中,先滴加过量的氯化钙溶液,观察现象。 | _____ | 氢氧化钠部分变质 |
(2)再向其中滴几滴酚酞溶液。 | 酚酞变红色。 |
实验中滴加过量氯化钙溶液的目的是_____。
在氢氧化钠溶液中滴加稀盐酸,溶液温度与滴加稀盐酸质量之间的变化关系如图所示:
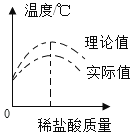
(1)实验中发现稀盐酸质量为m1时,测得的溶液温度最高,从能量的角度分析,氢氧化钠与稀盐酸的反应是_____反应;从反应进行的程度分析,温度达到最大值时,表示_____。随后溶液温度降低的原因是_____。
(2)实验数据分析可知测得的实际值低于理论值,请写出一点导致这种差异出现的原因_____。
【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动。请你和他们一起完成以下实验探究。
(演示实验)将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中。该反应的化学方程式是_____。
(查阅资料)CaCl2溶液显中性。
(提出问题)实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
(猜想与假设)针对疑问,甲组同学猜想如下:
猜想Ⅰ:只有CaCl2;猜想Ⅱ:有CaCl2和HCl;猜想Ⅲ:有CaCl2和Ca(OH)2;猜想Ⅳ:有CaCl2、HCl和Ca(OH)2。
乙组同学对以上猜想提出质疑,认为猜想Ⅳ不合理,其理由是_______。
(实验探究)为了验证其余猜想,各小组进行了下列三个方案的探究。
实验方案 | 滴加紫色石蕊溶液 | 通入CO2 | 滴加Na2CO3溶液 |
实验操作 |
|
|
|
实验现象 | ①______ | ②_______ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
(得出结论)通过探究,全班同学一致确定猜想Ⅲ是正确的。
(评价反思)(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因:_____。
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还需要考虑____。