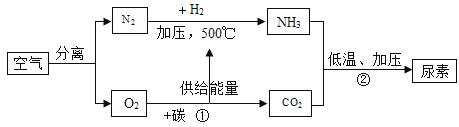
题目内容
【题目】根据图中实验回答下列问题。
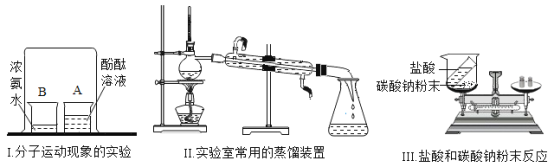
(1)实验I,烧杯_____(填“A”或“B”)中溶液变红;
(2)实验II,烧瓶中放入几粒沸石的作用是_____;
(3)实验III,观察到反应后天平不平衡,该反应是否符合质量守恒定律:_____(填“符合”或“不符合”),该反应前后,一定不变的是_____(填序号)。
a.原子种类 b.原子数目 c.分子种类 d.分子数目 e.元素种类 f.物质种类
【答案】A 防止加热时出现暴沸 符合 abe
【解析】
(1)浓氨水具有挥发性,氨气进入酚酞试液中形成氨水,氨水显碱性,能使酚酞变红色。实验I,烧杯A中溶液变红;
(2)实验II,烧瓶中放入几粒沸石的作用是防止加热时出现暴沸;
(3)由于装置没有密封,碳酸钠与盐酸反应产生的气体二氧化碳逸散到空气中,而使反应前后天平不平衡;如果二氧化碳气体不逸出,反应前后天平保持平衡;这一现象也从另一方面说明了该反应符合质量守恒定律;在化学变化过程中,原子是最小的微粒,原子的种类、个数一定不变,组成物质的元素的种类也一定不变;而分子的种类、物质的种类是一定发生改变的;分子的数目有时也会相等。该反应前后,一定不变的是abe;

 互动英语系列答案
互动英语系列答案【题目】研究性学习小组选择“过氧化氢(![]() )生成氧气(
)生成氧气(![]() )的快慢与什么因素有关”的课题进行探究,以下是他们探究的过程:
)的快慢与什么因素有关”的课题进行探究,以下是他们探究的过程:
(假设)![]() 生成
生成![]() 的快慢与催化剂种类有关。
的快慢与催化剂种类有关。
(实验方案)常温下,在两瓶同质量、同浓度的![]() 溶液中,分别加入相同质量的
溶液中,分别加入相同质量的![]() 和水泥块,测量各生成一瓶(相同体积)
和水泥块,测量各生成一瓶(相同体积)![]() 所需的时间。
所需的时间。
(进行实验)下图是他们进行实验的装置图,气体发生装置中A仪器的名称是________,此实验中B处宜采用的气体收集方法是________。

(实验记录)
实验编号 | 1 | 2 |
反应物 |
|
|
催化剂 | 1g水泥块 |
|
时间 | 165 s | 46 s |
(结论)该探究过程得出的结论是________________________________________。
(反思)![]() 在常温下分解缓慢,加入
在常温下分解缓慢,加入![]() 或水泥块后反应明显加快。若要证明二氧化锰(
或水泥块后反应明显加快。若要证明二氧化锰(![]() )和水泥块是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的________________________是否改变。
)和水泥块是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的________________________是否改变。
(实验拓展)![]() 生成
生成![]() 的快慢还与哪些因素有关?研究性学习小组进行了更深入的探究:
的快慢还与哪些因素有关?研究性学习小组进行了更深入的探究:
探究实验一:浓度对化学反应速率的影响
实验步骤 | 现象 | 结论 |
取一支试管加入5 mL 5%的过氧化氢溶液,然后加入等量的二氧化锰。 | 缓慢有少量气泡冒出 | ________________ |
另取一支试管加入5 mL 15%的过氧化氢溶液,然后加入等量的二氧化锰。 | 迅速有大量气泡冒出 |
请你设计:
实验用品:试管、烧杯、热水、冷水、5%过氧化氢溶液、15%过氧化氢溶液
探究实验二: ________________
实验步骤 | 现象 | 结论 |
取一支试管加入5 mL 15%的过氧化氢溶液,把试管放入盛有热水的烧杯中 | ________________ | 温度越高,过氧化氢分解的速率越大 |
取一支试管加入5 mL 15%的过氧化氢溶液,把试管放入盛有________的烧杯中 | ________________ |