题目内容
【题目】用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置,准确称取15克干燥样品进行实验。
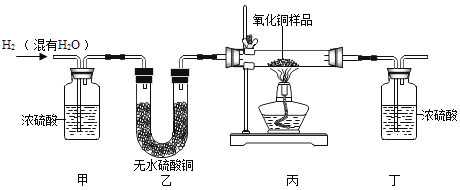
(1)实验中,乙装置的作用是_____。
(2)准确称取完全反应前后装置丙和丁的质量如表:
装置丙 | 装置丁 | |
反应前 | 48.8克 | 161.2克 |
反应后 | 46.5克 | 163.9克 |
小丽想根据装置丁的质量变化进行计算,请帮小丽求出氧化铜样品的纯度_____(写出计算过程)。
(3)根据以下原因计算,可能导致结果偏大的是_____。
A 装置的气密性不好
B 空气中的水分被丁处浓硫酸吸收
C 通入的氢气量不足
D 空气中的二氧化碳被丁处浓硫酸吸收
【答案】检验氢气中水蒸气是否完全除去 80% B
【解析】
(1)实验中,乙装置装有无水硫酸铜,遇到水蒸气变蓝色,作用是:检验氢气中水蒸气是否完全除去;
(2)丁装置中增加的质量为水的质量,则水的质量=163.9g-161.2g=2.7g;
解:设参加反应氧化铜的质量为x。
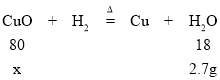
![]() x=12g
x=12g
氧化铜样品的纯度=![]() 。
。
(3)根据以下原因计算,可能导致结果偏大的是:
A、装置的气密性不好,导致水蒸气扩散,水的质量减小,氧化铜偏小;故选项错误;
B、空气中的水分被丁处浓硫酸吸收,则水的质量偏大,导致样品纯度偏大;故选项正确;
C、通入的氢气量不足,则产生水的质量偏小,计算出氧化铜偏小,导致样品纯度偏小;故选项错误;
D、空气中的二氧化碳不能被浓硫酸吸收,故选项错误;
故选:B。

【题目】某化学兴趣小组为测定大理石中碳酸钙的含量,进行如图 1 所示实验:将过量的稀盐酸加入到20 g大理石中(其他成分不与盐酸反应),把产生的CO2气体用足量的烧碱溶液吸收,同时测量 C 瓶烧碱溶液增加的质量,结果如下表所示:
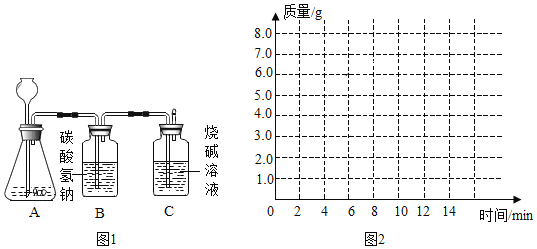
时间/分 | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
C 增加质量/g | 0 | 3.0 | 5.0 | 6.0 | 6.6 | x | 6.6 |
(1)上表中,第 10 分钟时,x=__________。
(2)计算大理石样品中碳酸钙的质量分数。_________(要写计算过程)
(3)请在如图 2 的坐标纸上,以时间为横坐标,以产生 CO2 气体的质量为纵坐标,画出能够表明产生气体的质量随时间变化规律的关系曲线(假设第 8 分钟是恰好反应结束)______________。
(4)B 中所装药品为碳酸氢钠溶液,作用是吸收挥发出的 HCl 气体,该装置使测量结果________(填“偏 大”“偏小”或“没有影响”)。