题目内容
【题目】武汉举行首届中国国际钢铁流通博览会,将商讨全球金属流通行业的战略性问题。则回答:
(1)金属材料的生产和使用是人类文明和社会进步的重要标志。常见三种金属铜、铁和铝被先后大规模的发现与使用,则其中的原因是(_____)
A 地壳中金属元素的含量 B 金属的导电性
C 金属的活动性顺序 D 金属的资源与价格
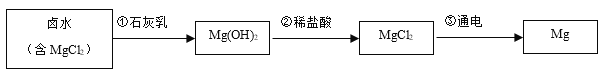
(2)大型钢铁企业常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,相关系列的化学反应过程如下:
![]()
请写出第①②步反应的化学方程式分别为_______________和__________。第③步反应的反应现象为______________________________。
(3)金属矿物的储量有限,而且不能再生。目前世界上已有50%以上的废钢铁得到回收利用,请说明其目的是________(填“合理开采矿物”、“节约金属资源”或“开发出金属的代用品”)。
【答案】C C+O2![]() CO2 CO2 +C
CO2 CO2 +C![]() 2CO 红褐色固体逐渐变成红热的“铁水”。 节约金属资源
2CO 红褐色固体逐渐变成红热的“铁水”。 节约金属资源
【解析】
(1)人类利用金属的历史:先是青铜器时代再到铁器时代,最后是铝制品。根据活动性顺序表:铝>铁>铜,对比金属活动性顺序与人类利用金属的先后发现,人类较早使用的金属活动性较弱,不同时期金属的冶炼方法和水平不同,导致人们使用的金属材料不同。
A. 地壳中金属元素的含量最多的是铝,但是人类利用的却是较晚的,说明人类对金属的使用先后与地壳中金属的含量无关。故A选项不符合题意;
B. 人类对金属的使用先后与金属的导电性无关。故B选项不符合题意;
C. 人类对金属的使用先后主要与金属的活动性顺序有关,除此之外还与当时的金属冶炼水平有关。故C选项符合题意;
D. 人类对金属的使用先后与金属资源的价格无关。故D选项不符合题意。
故答案为:C。
(2)焦炭在炼铁过程中的作用:1.燃烧放热,提高炉温;2.提供还原剂CO。第①步氧气非常充足,焦炭充分燃烧,反应方程式为:C+O2![]() CO2;第②步:CO2与焦炭在高温条件下被还原成CO,反应的方程式为:CO2+C
CO2;第②步:CO2与焦炭在高温条件下被还原成CO,反应的方程式为:CO2+C![]() 2CO;第③步赤铁矿石被还原成铁,因为是炼钢厂的高炉温度非常高,高过铁的熔点,最后还原出来的铁是红热的 “铁水”,即液态铁单质,将这些“铁水”倒入一定的模具中冷却定型后就成为钢铁。故现象是红褐色的固体(赤铁矿石的颜色为红褐色)变成红热的液态 “铁水”。
2CO;第③步赤铁矿石被还原成铁,因为是炼钢厂的高炉温度非常高,高过铁的熔点,最后还原出来的铁是红热的 “铁水”,即液态铁单质,将这些“铁水”倒入一定的模具中冷却定型后就成为钢铁。故现象是红褐色的固体(赤铁矿石的颜色为红褐色)变成红热的液态 “铁水”。
故答案为:C+O2![]() CO2;CO2+C
CO2;CO2+C![]() 2CO;红褐色的固体逐渐变成红热的液态 “铁水”。
2CO;红褐色的固体逐渐变成红热的液态 “铁水”。
(3)目前世界上已有50%以上的废钢铁得到回收利用,说明人们意识到金属资源的有限性和不可再生,希望通过回收再利用的方法达到节约金属资源的目的。
故答案为:节约金属资源。

【题目】如表是Na2CO3、NaCl的溶解度。
温度 | Na2CO3 | NaCl |
20℃ | 21.8g | 36.0g |
30℃ | 39.7g | 36.3g |
20℃时,向2只盛有100g水的烧杯中,分别加入30g两种固体,充分溶解。下列说法正确的是( )
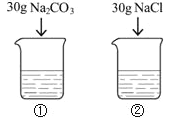
A. 烧杯①中溶质与溶剂的质量比为3:10
B. 烧杯②中溶质的质量分数为30%
C. 烧杯①中溶液升温至30℃,溶质质量分数不变
D. 烧杯①②中溶液升温至30℃(忽略水的蒸发),溶液质量①=②