题目内容
【题目】绿矾(FeSO4·7H2O)是一种重要的食品添加剂。某工厂产生的炉渣主要含有FeO和Fe2O3,还有一定量的SiO2(SiO2不溶于水、不与稀硫酸反应)。实验室以此炉渣制备绿矾的流程如下:

(1)步骤①实验时需用到的玻璃仪器是___________、玻璃棒和烧杯。该过程发生反应的化学方程式为:①FeO+H2SO4=FeSO4+H2O,②__________________。
(2)滤液A中含有的溶质有FeSO4、_______________。
(3)加入试剂X的目的是将Fe3+转化为Fe2+,试剂X可用SO2或Fe。
①若试剂X是SO2,转化原理为SO2+Fe2(SO4)3+2H2O=2FeSO4+2Y,则Y的化学式是__________。
②若试剂X是Fe,转化原理为Fe+ Fe2(SO4)3=3FeSO4。测得反应后溶液的pH明显增大,其原因是__________________。
(4)步骤③的操作是蒸发浓缩、___________、过滤,即得到绿矾晶体。
【答案】漏斗 ![]() Fe2(SO4)3、H2SO4 H2SO4 铁消耗过量硫酸,溶液酸性减弱,所以pH增大 冷却结晶(或结晶)
Fe2(SO4)3、H2SO4 H2SO4 铁消耗过量硫酸,溶液酸性减弱,所以pH增大 冷却结晶(或结晶)
【解析】
(1)步骤①实现了固液分离,故步骤①是过滤,过滤需用到的玻璃仪器是:烧杯、漏斗、玻璃棒;
向炉渣中加入过量稀硫酸,FeO与稀硫酸反应生成硫酸亚铁和水,该反应的化学方程式为:![]() ,三氧化二铁与稀硫酸反应生成硫酸铁和水,该反应的化学方程式为:
,三氧化二铁与稀硫酸反应生成硫酸铁和水,该反应的化学方程式为:![]() ;
;
(2)FeO与稀硫酸反应生成硫酸亚铁和水,三氧化二铁与稀硫酸反应生成硫酸铁和水,且稀硫酸过量,故滤液A中含有的溶质有FeSO4、Fe2(SO4)3、H2SO4;
(3)①根据质量守恒定律,化学反应前后,原子的种类和数目不变,结合化学方程式: ![]() ,反应前硫原子是4个,反应后应该是4个,其中2个包含在2Y中,反应前氧原子是16个,反应后应该是16个,其中8个包含在2Y中,反应前后铁原子都是2个,反应前氢原子是4个,反应后应该是4个,包含在2Y中,则Y的化学式是:H2SO4;
,反应前硫原子是4个,反应后应该是4个,其中2个包含在2Y中,反应前氧原子是16个,反应后应该是16个,其中8个包含在2Y中,反应前后铁原子都是2个,反应前氢原子是4个,反应后应该是4个,包含在2Y中,则Y的化学式是:H2SO4;
② 若试剂X是铁,铁能与过量的稀硫酸反应生成硫酸亚铁和氢气,溶液酸性减弱,所以pH增大,故填:铁消耗过量硫酸,溶液酸性减弱,所以pH增大;
(4)硫酸亚铁溶液通过步骤③变成FeSO4·7H2O晶体,故步骤③为蒸发浓缩、冷却结晶、过滤。

【题目】用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置,准确称取15克干燥样品进行实验。
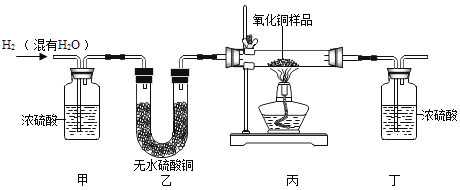
(1)实验中,乙装置的作用是_____。
(2)准确称取完全反应前后装置丙和丁的质量如表:
装置丙 | 装置丁 | |
反应前 | 48.8克 | 161.2克 |
反应后 | 46.5克 | 163.9克 |
小丽想根据装置丁的质量变化进行计算,请帮小丽求出氧化铜样品的纯度_____(写出计算过程)。
(3)根据以下原因计算,可能导致结果偏大的是_____。
A 装置的气密性不好
B 空气中的水分被丁处浓硫酸吸收
C 通入的氢气量不足
D 空气中的二氧化碳被丁处浓硫酸吸收