题目内容
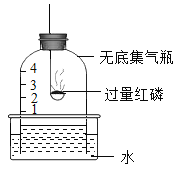
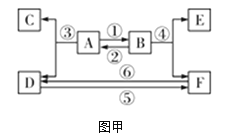
【题目】海洋中蕴藏着丰富的化学资源,从海水中提取金属镁的主要步骤如下:资料:海滩贝壳的主要成分是CaCO3

(1)为节约资源,试剂A常用海滩贝壳为原料制得,则试剂X为__________(填化学式)。
(2)操作Y的名称为_____________________。
(3)在熔融状态下的MgCl2,通电后会生成镁与一种气体单质,该反应的化学方程式为___________;
【答案】![]() 过滤
过滤 
【解析】
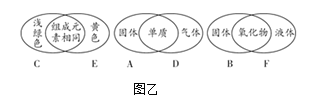
(1)为节约资源,试剂A常用海滩贝壳为原料制得,海滩贝壳的主要成分是CaCO3,煅烧CaCO3生成氧化钙,氧化钙与水反应生成氢氧化钙,氢氧化钙与硫酸镁反应生成氢氧化镁沉淀和磷酸钙,则试剂X为![]() 。
。
(2)操作Y是将固液分离,名称为过滤。
(3)在熔融状态下的MgCl2,通电后会生成镁与一种气体单质,气体应是氯气,该反应的化学方程式为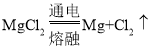 。
。

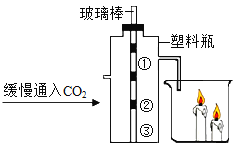
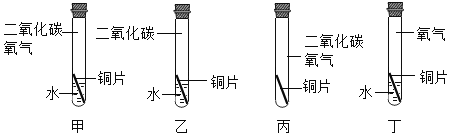
【题目】碳还原氧化铜的实验装置如图甲、乙所示。甲图中酒精灯上网罩的作用是___。
(提出问题)碳燃烧时可能生成CO2也可能生成CO2,那么碳与氧化铜反应生成的气体是否也有多种可能?
(作出猜想)猜想I:CO;
猜想Ⅱ:CO2;
猜想Ⅲ:___。
(设计方案)实验装置如图乙所示。打开K,缓缓通入干燥的氮气一段时间,关闭K,点燃酒精喷灯和酒精灯,充分反应后,熄灭酒精喷灯和酒精灯,打开K,再通入一段时间氮气。
方案一:从定性观察角度判断
(1)实验时装置A处的现象是_____。
(2)若B中无明显现象,D处的气体能点燃,则猜想___(填序号)成立。
方案二:从定量计算角度判断:取一定量碳粉和4g氧化铜的混合物进行实验,并测定表格中的四个数据:
反应前的质量 | 反应后的质量 | |
A(玻璃管+固体) | m1 | m2 |
B+C(广口瓶+混合液) | m3 | m4 |
(3)若猜想Ⅱ成立,则理论上(m4-m3)__(m1-m2)(填“>”“<”或“=”)。
(4)若猜想Ⅲ成立且CuO全部转化成Cu,则参加反应的碳粉的质量m的取值范围是____。
(交流反思)实验开始前缓缓通入氮气的目的是_______。
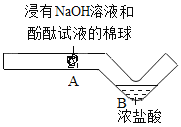
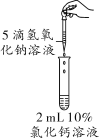
【题目】(2018保定竞秀区模拟)在化学分组实验中,某同学无意中向2 mL 10%的氯化钙溶液中滴加氢氧化钠溶液,出现了白色沉淀。
小组同学非常感兴趣,想探究竟。
(提出问题)生成的白色沉淀是什么?
(猜想与假设)
①氢氧化钠溶液变质,生成的白色沉淀是________。
②氢氧化钠溶液浓度较大,生成的白色沉淀是氢氧化钙。
(进行实验)甲同学针对猜想①进行实验。
氢氧化钠溶液变质的化学反应方程式是__________________________。
实验步骤 | 实验现象 | 实验结论 |
将浑浊液过滤,取少量滤渣于烧杯中,加入足量水 | ________ | 猜想①不成立 |
乙同学提出还可以用另外一种方法证明猜想①不成立:取少量滤渣于试管中,滴加足量稀盐酸,若观察到________________现象,可以验证他的设想。
丙同学针对猜想②进行实验
(实验操作)取5支试管,向其中分别加入2 mL 10%氯化钙溶液,再分别滴加5滴浓度为0.4%、0.5%、1%、2%、4%的氢氧化钠溶液,实验现象如下表:
氢氧化钠溶液浓度/% | 是否浑浊 |
0.4 | 几乎不浑浊 |
0.5 | 略有浑浊 |
1 | 明显浑浊 |
2 | 明显浑浊 |
4 | 明显浑浊 |
(解释与结论)(1)丙同学实验证明猜想②成立,能否出现浑浊与氢氧化钠溶液浓度的关系是______________________________。
(2)请你解释生成的沉淀是氢氧化钙的原因是________________________。
(实验拓展)鉴别氢氧化钠溶液是否变质,由上面实验可知,鉴别的药品不能使用氯化钙溶液,请你选择一种鉴别的试剂________。