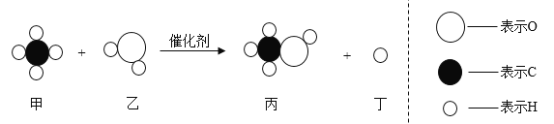
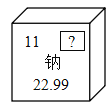
题目内容
【题目】根据下列实验装置图,回答有关问题。
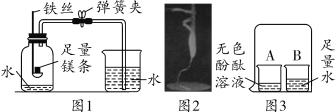
a.  测定空气中氧气的含量
测定空气中氧气的含量
b. 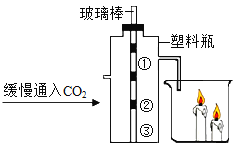 探究二氧化碳的性质
探究二氧化碳的性质
c. 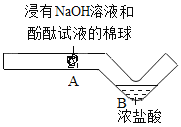 探究中和反应
探究中和反应
(1)A实验中使用过量红磷的目的是________,该实验能得出的结论是________。
(2)B图所示实验中,①③为湿润的石蕊试纸,②为干燥石蕊试纸。将高、矮蜡烛点燃。塑料瓶中发生反应的化学方程式为_________。该实验能说明二氧化碳具有的化学性质是_________。
(3)C图所示实验能说明发生了中和反应的现象是__。该实验的优点是____________(写一点)。
【答案】将氧气充分耗尽 氧气约占空气体积的五分之一 ![]() 二氧化碳能与水反应生成弱酸(碳酸);不燃烧不支持燃烧 棉球由红色变为无色 节约药品、环保
二氧化碳能与水反应生成弱酸(碳酸);不燃烧不支持燃烧 棉球由红色变为无色 节约药品、环保
【解析】
(1)实验A是测定空气中氧气的含量,需要完全将瓶内的氧气完全消耗,然后在大气压的作用下,瓶中的水上升,瓶中水上升的体积就是瓶中空气中氧气的体积,因此A实验中使用过量红磷的目的是将氧气充分耗尽,该实验能得出的结论是氧气约占空气体积的五分之一。
(2)实验B探究二氧化碳的性质,塑料瓶中湿润的石蕊试纸变为红色,干燥石蕊试纸不变色,说明二氧化碳能与水反应生成酸,反应的方程式为![]() ;塑料瓶中石蕊试纸的变化说明二氧化碳能与水反应生成弱酸(碳酸),烧杯中的蜡烛燃烧说明二氧化碳气体不能燃烧也不支持燃烧。
;塑料瓶中石蕊试纸的变化说明二氧化碳能与水反应生成弱酸(碳酸),烧杯中的蜡烛燃烧说明二氧化碳气体不能燃烧也不支持燃烧。
(3)实验C探究中和反应,浸有氢氧化钠溶液和酚酞溶液的棉球呈红色,酸碱中和反应之后,碱性减弱直至消失,因此酚酞逐渐褪色,现象是棉球由红色变为无色。该实验都在容器内进行因此优点是节约药品、环保

练习册系列答案
相关题目