题目内容
【题目】下图是实验室常用气体制备装置,据图回答问题:
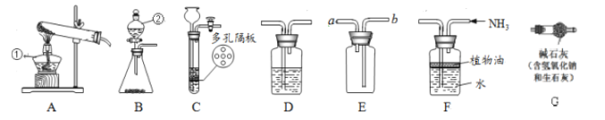
(1)写出有标号的仪器名称:①___________,②___________。
(2)用氯酸钾制氧气选用的发生装置是_______(选填序号),反应的化学方程式为____。
(3)若B装置中固体为二氧化锰,②中加入_________试剂可制O2。要获得干燥的O2,应先将气体通过盛有_______的D装置,再用E装置收集,气体应从_________端通入(选填“a”或“b”)。
(4)实验室可用B或C装置制CO2, C相对于B装置的优点有______。
(5)实验室制取氨气:Ca(OH)2(固)+2NH4Cl(固)![]() CaCl2(固)+2H2O+2NH3↑,要制取并收集干燥的氨气,所选装置正确的连接顺序是_________→ _________→F (填字母代号)。
CaCl2(固)+2H2O+2NH3↑,要制取并收集干燥的氨气,所选装置正确的连接顺序是_________→ _________→F (填字母代号)。
(6)为探究氨气的性质,按如图装置进行实验。观察到黑色粉末变红,白色无水硫酸铜变蓝,同时反应中还有一种气体单质生成。
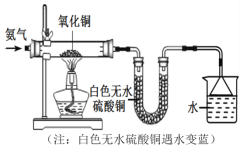
(查阅资料)Cu2O是红色,易与稀硫酸反应:Cu2O+H2SO4==CuSO4+Cu+H2O。
(提出问题)得到的红色物质是什么?
(猜想)①是Cu;②是Cu2O;③是_______。
若猜想①成立,玻璃管中发生反应的化学方程式为_________,说明NH3具有________性。
(设计实验)请你设计一个简单的实验来验证红色物质中是否存在Cu2O:____。
【答案】酒精灯 分液漏斗 A 2KClO3![]() 2KCl + 3O2 ↑ 过氧化氢溶液 浓硫酸 b 可以控制反应的发生和停止 A G Cu和Cu2O的混合物 2NH3+3CuO
2KCl + 3O2 ↑ 过氧化氢溶液 浓硫酸 b 可以控制反应的发生和停止 A G Cu和Cu2O的混合物 2NH3+3CuO ![]() 3Cu+N2+3H2O 还原 取少量红色物质放于试管,向试管中倒入稀硫酸,若溶液逐渐变为蓝色则有Cu2O,若溶液不变色,则无Cu2O。
3Cu+N2+3H2O 还原 取少量红色物质放于试管,向试管中倒入稀硫酸,若溶液逐渐变为蓝色则有Cu2O,若溶液不变色,则无Cu2O。
【解析】
(1)根据常见仪器的名称解答;
(2)根据反应物的状态与反应的条件确定制取装置,根据反应原理来书写化学方程式;
(3)根据制取氧气的基本原理、干燥氧气的方法以及氧气的性质来分析;
(4)根据装置的特点来分析;
(5)根据气体的制备、干燥与收集方法来分析;
(6)猜想:据质量守恒定律反应前后元素种类不变可知红色物质还可能是铜和氧化亚铜 的混合物;并据反应原理书写方程式,氨气使氧化铜被还原为铜,夺取了氧化铜中的氧元素,说明其具有还原性;
设计实验:据氧化亚铜可与硫酸反应设计实验进行检验。
(1)仪器①是酒精灯,②是分液漏斗;
(2)用氯酸钾制氧气,反应物的状态是固体,反应条件是加热,属于固体加热型,选择装置A来制取氧气;氯酸钾在二氧化锰作催化剂加热的条件下分解为氯化钾和氧气,反应的化学方程式是2KClO3![]() 2KCl + 3O2 ↑;
2KCl + 3O2 ↑;
(3)B装置适用于固—液常温下制取氧气,过氧化氢溶液在二氧化锰催化作用下分解生成氧气和水,若B装置中固体为二氧化锰,②中加入过氧化氢溶液可制O2;浓硫酸具有吸水性,可用盛有浓硫酸的D装置来对氧气进行干燥,氧气的密度比空气大,所以用装置E收集氧气时,氧气应从b(长)管进入;
(4)在装置C中,固体药品物放在多孔隔板上,液体药品从长颈漏斗中加入。关闭开关时,试管中的气体增多,压强增大,把液体压入长颈漏斗,固体和液体分离,反应停止,打开开关时,气体导出,试管中的气体减少,压强减小,液体和固体混合,反应进行。C相对于B装置的优点有可以控制反应的发生与停止;
(5)根据“实验室制取氨气:Ca(OH)2(固)+2NH4Cl(固)![]() CaCl2(固)+2H2O+2NH3↑”可知,实验室制取氨气属于固体加热型,所以选择装置A来制取,氨气应该用碱石灰来干燥,然后用装置F从短管进入氨气来收集,所以所选装置正确的连接顺序是A→G→F;
CaCl2(固)+2H2O+2NH3↑”可知,实验室制取氨气属于固体加热型,所以选择装置A来制取,氨气应该用碱石灰来干燥,然后用装置F从短管进入氨气来收集,所以所选装置正确的连接顺序是A→G→F;
(6)猜想:据质量守恒定律反应前后元素种类不变可知红色物质还可能是Cu和Cu2O的混合物;
若猜想①成立,则氧化铜全部转化成光亮的红色固体是铜;硫酸铜白色粉末变蓝说明有水的产生;还有一种无色气态单质,根据化学反应前后元素的种类不变,气体是氮气,故反应的方程式2NH3+3CuO ![]() 3Cu+N2+3H2O;氨气使氧化铜被还原为铜,夺取了氧化铜中的氧元素,说明其具有还原性;
3Cu+N2+3H2O;氨气使氧化铜被还原为铜,夺取了氧化铜中的氧元素,说明其具有还原性;
设计实验:根据“查阅资料”可知:Cu2O是红色,易与稀硫酸反应生成蓝色的硫酸铜溶液,而铜排在顺序表中氢的后面,与硫酸不反应。可取少量红色物质放于试管,向试管中倒入稀硫酸,观察溶液是否变蓝判断是否含有氧化亚铜。验证红色物质中是否存在Cu2O实验可设计为:取少量红色物质放于试管,向试管中倒入稀硫酸,若溶液逐渐变为蓝色则有Cu2O,若溶液不变色,则无Cu2O。

 名题金卷系列答案
名题金卷系列答案