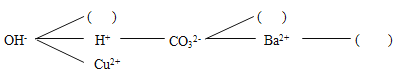��Ŀ����
����Ŀ����֪ij������Ʒ�к�������MgCl2��CaCl2�����������ʣ����ʲ����Լ���Ӧ����ij�о���ѧϰС��Ըô��ε��ᴿ������̽�����������ʵ�����̣������ͼʾ�ش��������⣺
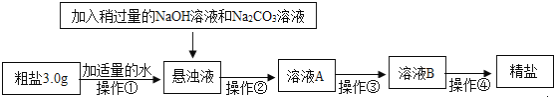
��1�������ڵ�Ŀ����Ϊ�˳�ȥ������Ʒ�еIJ��������ʼ����ɵ�_____��______ ���ѧʽ���������ʣ����ڲ����ڽ���������ҺA�Ի��ǣ�Ӧ��ȡ�Ĵ�ʩ��_____________��
��2�����������ڼ��������²��ϵμ�ϡ��������Һ��pH=7���ò�����Ŀ����_______��
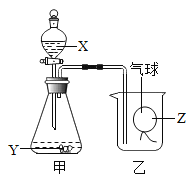
��3���������ǽ���ҺB�����������У����Ȳ����Ͻ��裬ֱ��__________��������ֹͣ���ȣ����ȹ����в��Ͻ����Ŀ���ǣ�___________ ��
���𰸡�Mg(OH)2 CaCO3 �ٹ���һ�Ρ������Ȼ���ǣ���Ҫ����ԭ�����ֽ�Ƿ����𡢹���ʱ��������Һ���Ƿ������ֽ��Ե��������Һ���ձ��Ƿ�ɾ��� ��ȥ��ҺA�к��е��������ƺ�̼���� �������г��ֽ϶�������ʱ ��ֹҺ��ֲ��¶ȹ��ߣ����Һ�ηɽ���
��������
��1����Ϊ�����ٽ������ܽ�����Թ���������������Һ��̼������Һ�������е�MgCl2��CaCl2ת��Ϊ������þ��̼��Ƴ��������Բ����ڵ�Ŀ����Ϊ�˳�ȥ������Ʒ�еIJ��������ʼ����ɵ�Mg(OH)2��CaCO3�������ʡ����ڲ����ڽ���������ҺA�Ի��ǣ�Ӧ��ȡ�Ĵ�ʩ�ǣ��ٹ���һ�Σ������Ȼ���ǣ���Ҫ����ԭ�����ֽ�Ƿ����𡢹���ʱ��������Һ���Ƿ������ֽ��Ե��������Һ���ձ��Ƿ�ɾ���
��2����Ϊ��ҺA�к��в������м���Ĺ����������ƺ�̼���ƣ��������ᣬ�������ơ�̼���ƶ������ᷴӦ�����Ȼ��ƣ�����Һ��pH=7ʱ���������ƺ�̼���ƶ�ǡ����ȫ��Ӧ�������ڷ�Ӧʱ���ȣ����������ɵĶ�����̼���ݳ������Բ������ڼ��������²��ϵμ�ϡ��������Һ��pH=7��Ŀ���ǣ���ȥ��ҺA�к��е��������ƺ�̼���ơ�
��3����������ʱ�����������г��ֽ϶����ʱ��ֹͣ���ȣ����ܽ���Һ���ɣ�������ɽ�����ɾ��彦����������˽���ҺB�����������У����Ȳ����Ͻ��裬ֱ���������г��ֽ϶�������ʱ��ֹͣ���ȡ����ȹ����в��Ͻ����Ŀ���ǣ���ֹҺ��ֲ��¶ȹ��ߣ����Һ�ηɽ���