题目内容
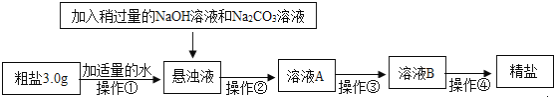
【题目】食盐是一种重要的化工原料。粗盐中常含有少量的CaCl2、MgCl2、Na2SO4等杂质,将粗盐进行精制的流程如图:

(1)过量X(纯净物)溶液中的溶质是_____。
(2)加入过量的碳酸钠溶液作用之一是_____(用化学方程式表示。)
(3)请设计实验方案证明滤液B中含有Na2CO3和NaOH_____.(写出实验步骤和现象)。
【答案】氢氧化钡 Na2CO3+CaCl2=CaCO3↓+2NaCl,或Na2CO3+Ba(OH)2=BaCO3↓+2NaOH,或Na2CO3+BaCl2=BaCO3↓+2NaCl 取少量溶液B于试管中,加入足量CaCl2溶液,产生白色沉淀,充分反应后过滤,向滤液中滴加酚酞试液,溶液变红
【解析】
氢氧化钡和氯化镁反应生成氢氧化镁沉淀和氯化钡,和硫酸钠反应生成硫酸钡沉淀和氢氧化钠;碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,和氯化钡反应生成碳酸钡沉淀和氯化钠;碳酸钠溶液和氢氧化钠溶液都是显碱性溶液,都能使酚酞试液变红色。
(1)过量X(纯净物)溶液中的溶质是氢氧化钡,加入氢氧化钡后,氢氧化钡和氯化镁反应生成氢氧化镁沉淀和氯化钡,和硫酸钠反应生成硫酸钡沉淀和氢氧化钠。
(2)加入过量的碳酸钠溶液作用:除去氯化钙、过量的氢氧化钡、反应生成的氯化钡,这是因为碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,和氯化钡反应生成碳酸钡沉淀和氯化钠,反应的化学方程式为Na2CO3+CaCl2=CaCO3↓+2NaCl,或Na2CO3+Ba(OH)2=BaCO3↓+2NaOH,或Na2CO3+BaCl2=BaCO3↓+2NaCl。
(3)实验方案为取少量溶液B于试管中,加入足量CaCl2溶液,产生白色沉淀,说明溶液中含有碳酸钠,充分反应后过滤,向滤液中滴加酚酞试液,溶液变红,说明溶液中含有氢氧化钠。