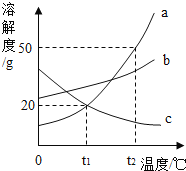
题目内容
【题目】为保护绿水青山,可将工业残留的钡渣[主要成分为碳酸钡(BaCO3)]进行无害化处理,制取化工原料硫酸钡(BaSO4)。主要流程如下:
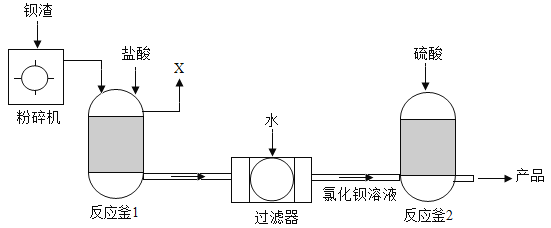
已知:BaSO4难溶于水,氯化钡(BaCl2)可溶于水。
(1)粉碎钡渣的目的是_______。
(2)反应釜1中的气体X为_______。
(3)反应釜2中发生复分解反应的化学方程式为_______。
(4)从反应釜2到产品还要经过一步必要的操作,应该是_______。
【答案】增大反应物的接触面积,加快反应速率,使其充分反应 CO2 BaCl2+H2SO4=BaSO4↓+2HCl 过滤
【解析】
(1)由于反应物之间接触面积越大,反应越快,转化率也越高,所以粉碎钡渣的目的是增大反应物的接触面积,加快反应速率,使其充分反应;
(2)由于钡渣的主要成分为碳酸钡,所以加入盐酸应该生成氯化钡和水以及二氧化碳,所以反应釜1中的气体X的化学式为 CO2;
(3)反应釜2中是氯化钡和硫酸反应生成硫酸钡和HCl,对应的化学方程式为 BaCl2+H2SO4=BaSO4↓+2HCl;
(3)BaSO4难溶于水,氯化钡(BaCl2)可溶于水,要分离出硫酸钡需要经过过滤操作。

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目