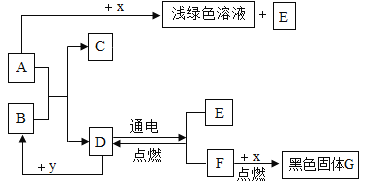
��Ŀ����
����Ŀ��Ϊ�ⶨʯ��ʯ��Ʒ��̼��Ƶ�����������ijѧϰС�����������ʵ��̽����ȡ10gʯ��ʯ��Ʒ�����ձ��У�����ϡ���������ٲ������ݣ�ʯ��ʯ�е����ʲ�����ˮ��Ҳ����Ӧ�����������˼���ϡ�����������ų���������������ͼ����ͼ��

��1��̼�����ȫ��ӦӦ��ȥϡ���������Ϊ_______��
��2�����ʯ��ʯ��Ʒ��̼��Ƶ���������_______��
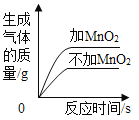
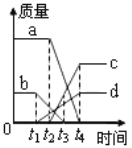
��3���뻭����ϡ��������Ϊ�����ꡢʯ��ʯʣ���������Ϊ������ı仯ͼ��_______��
���𰸡�84.32g 80% 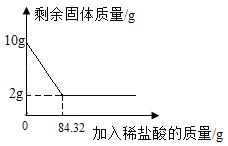
��������
����̼�����ϡ���ᷴӦ��ѧ����ʽ���㼰ͼʾ��Ϣ���з������
��1����ͼʾ��Ϣ��֪������ϡ����84.32g����������������������ӣ��ʵ�����84.32gϡ����ʱ̼�����ȫ��Ӧ��
��2����10g��Ʒ��̼��Ƶ�����Ϊx��
![]()
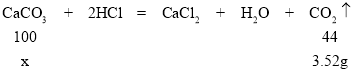
![]() ��x=8g���ʸ�ʯ��ʯ��Ʒ��̼��Ƶ���������Ϊ
��x=8g���ʸ�ʯ��ʯ��Ʒ��̼��Ƶ���������Ϊ![]() ��
��
��3����Ʒ����Ϊ10g����ͼ�����������Ϊ10g��10g��Ʒ�к�̼���8g����ͼ��������ƽ���Ϊ2���ҵ�̼��Ʒ�Ӧ�������ĵ�ϡ����Ϊ84.32g������ϡ��������Ϊ�����ꡢʯ��ʯʣ���������Ϊ������ı仯ͼ��Ϊ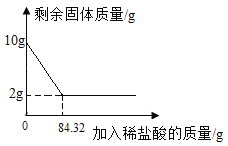 ��
��

����Ŀ����ѧʵ������ϣ���ʦ����һ����ĩ�������ɳ��ڷ����ڿ����е����ۺ;��õļ�ʯ�Ҹ������϶��ɡ���ͬѧ�����ʵ�����̽����
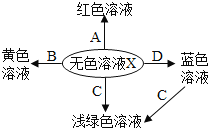
[�������]������Ʒ�ijɷ���ʲô?
[��������] ��1����ʯ�Ҹ������CaO��NaOH�Ļ���
��2��BaCl2��Һ�����ԡ�
[���������]
������Ʒ�п��ܺ���Fe��Fe2O3�� CaO�� NaOH��Ca(OH)2��Na2CO3��_________���������ʡ�
[����ʵ��]��ͼ
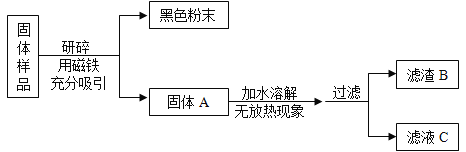
����ͬѧ������B�ijɷֽ���̽������¼����:
ʵ����� | ʵ������ | ʵ����ۼ���ѧ����ʽ |
ȡ��������B���Թ��У���������ϡ���ᣬ�����ɵ�����ͨ������ʯ��ˮ�� | ��____ ��_____ | ����:����B����Fe2O3��CaCO3��ʵ������з�Ӧ�Ļ�ѧ����ʽΪ:__ |
����ͬѧ����ҺC�ijɷֽ�����̽������¼����:
ʵ����� | ʵ������ | ʵ����� |
ȡ������ҺC���Թ��У��������BaCl2��Һ�����ã����ϲ���Һ�еμ���ɫ��̪��Һ���� | ���а�ɫ�������� �ڷ�̪��Һ����ɫ��ɺ�ɫ | ��ҺC����___ |
[���������]
��1������ͬѧʵ���м������BaCl2��Һ��Ŀ����__________��
��2��ͨ������ʵ��̽�����ù�����Ʒ����ȷ��һ�����еijɷ���_______��