题目内容
【题目】下列化学用语的描述不正确的是( )
A.N2、N2O3、NaNO2、NH4NO3、NH3五种物质中N元素化合价共有四种
B.α粒子是带2个正电荷、相对质量为4的单核微粒,其实就是He的原子核
C.某微粒核外电子排布示意图为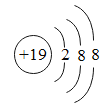 ,该微粒位于元素周期表第三周期
,该微粒位于元素周期表第三周期
D.符号Ar可以表示氩元素或氩气或1个氩原子
【答案】C
【解析】
A、根据单质中元素的化合价为0,化合物中正负化合价的代数和为0计算解答;
B、根据He的原子结构进行分析解答;
C、根据元素的周期数等于其原子核外电子层数进行分析解答;
D、根据元素符号的意义进行分析。
A、N2为单质,则N元素的化合价为0;N2O3中O元素的化合价为-2,由化合物中正负化合价的代数和为0,则N元素的化合价为+3:NaNO2中Na元素的化合价为+1,O为-2,则N元素的化合价为+3:NH4NO3中铵根为+1价,硝酸根为-1价,氨根中N元素的化合价为-3,硝酸根中N元素的化合价为+5;NH3中氢元素的化合价为+1,则N元素的化合价为-3,所以N元素表现出的化合价共有四种,此说法正确;
B、He的原子核是带2个正电荷、相对质量为4的单核微粒,即a粒子,此说法正确;
C、某微粒核外电子排布为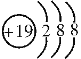 ,该微粒是其原子失去一个电子形成的,其原子有四个电子层,元素的周期数等于其原子核外电子层数,该微粒位于元素周期表第四周期,此说法错误;
,该微粒是其原子失去一个电子形成的,其原子有四个电子层,元素的周期数等于其原子核外电子层数,该微粒位于元素周期表第四周期,此说法错误;
D、符号Ar既是元素符号,又是化学式,可以表示氩元素或氩气或1个氩原子,此说法正确;
故选C。

【题目】化学实践活动课上,老师拿来一包粉末。它是由长期放置在空气中的铁粉和久置的碱石灰干燥剂混合而成。让同学们设计实验进行探究。
[提出问题]固体样品的成分是什么?
[查阆资料] (1)碱石灰干燥剂是CaO和NaOH的混合物。
(2)BaCl2溶液是中性。
[猜想与假设]
固体样品中可能含有Fe、Fe2O3、 CaO、 NaOH、Ca(OH)2、Na2CO3和_________等七种物质。
[进行实验]如图
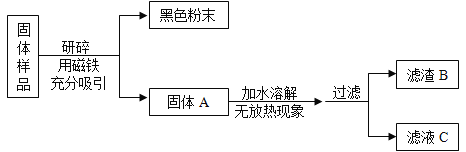
甲组同学对滤渣B的成分进行探究,记录如下:
实验操作 | 实验现象 | 实验结论及化学方程式 |
取少量滤渣B于试管中,加入足量稀盐酸,将生成的气体通入澄清的石灰水中 | ①____ ②_____ | 结论:滤渣B中有Fe2O3、CaCO3。实验操作中反应的化学方程式为:__ |
乙组同学对滤液C的成分进行了探究。记录如下:
实验操作 | 实验现象 | 实验结论 |
取少量滤液C于试管中,加入过量BaCl2溶液,静置,向上层清液中滴加无色酚酞试液,振荡 | ①有白色沉淀生成 ②酚酞试液由无色变成红色 | 滤液C中有___ |
[解释与结论]
(1)乙组同学实验中加入过量BaCl2溶液的目的是__________。
(2)通过以上实验探究。该固体样品中能确定一定含有的成分是_______。
【题目】如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,将产生氨气。立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )
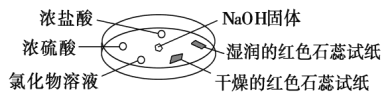
选项 | 实验现象 | 解释 |
① | 浓盐酸附近产生白烟 | NH3与HCl反应生成了NH4Cl固体 |
② | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
③ | 氯化物溶液中有红褐色沉淀 | 该溶液一定有FeCl3溶液 |
④ | 干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
A.②③④
B.①③④
C.①③
D.③④