��Ŀ����
����Ŀ��ʵ������ͭ��������ȡCuSO4�����м���������
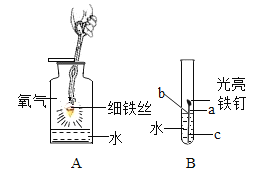
��1����ѧ������������ʵ�飺ȡ6.4gͭƬ��10mLijŨ�ȵ�Ũ�������Բ����ƿ�й��ȣ�������Һ���������ɫ��ͬʱ�д̼�����ζ�������ɡ�д����Ӧ�Ļ�ѧ����ʽ_____��ֱ����Ӧ��ϣ��������ƿ�л���ͭƬʣ�ࡣ�������Լ���ѧ�Ļ�ѧ֪ʶ����Ϊ��ƿ�л��н϶������ʣ�ࡣ��������Ϊ�������ǣ�_____��
��2����ͬѧ��Ϊ����Ƶ�ʵ�鷽�����ã����Լ���Ƶ�˼·�ǵ�һ����![]() �ڶ�����_____���Աȼķ�������ͬѧ���ŵ���_____��_____��
�ڶ�����_____���Աȼķ�������ͬѧ���ŵ���_____��_____��
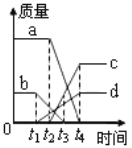
���𰸡�![]() ���ŷ�Ӧ���У�Ũ����Ũ����С����������Cu��Ӧ
���ŷ�Ӧ���У�Ũ����Ũ����С����������Cu��Ӧ ![]() ��ȡͬ����CuSO4�������ĵ�������� ��������Ⱦ����SO2
��ȡͬ����CuSO4�������ĵ�������� ��������Ⱦ����SO2
��������
��1��ͭƬ��Ũ�������Բ����ƿ�й��ȣ�������Һ���������ɫ��ͬʱ�д̼�����ζ�������ɣ���ɫ��ҺӦ��������������ͭ�����������غ㶨�ɻ�ѧ��Ӧǰ��Ԫ�ص�����䣬��Ӧ���к�Cu��H��S��O�������ɵĴ̼�����ζ������Ӧ�Ƕ��������������к�Cu��S��O���ʻ�Ӧ����Ԫ�أ���Ӧ��ˮ���ɣ��÷�Ӧ�Ļ�ѧ����ʽΪ��![]() ��
��
���ŷ�Ӧ�Ľ��У�Ũ�����Ũ����С����Ϊϡ���ᣬ�ڽ������˳���ͭλ����֮��ͭ��ϡ�����Ӧ���ʻ��н϶�����ʣ�࣬������ŷ�Ӧ���У�Ũ����Ũ����С����������Cu��Ӧ��
��2��ͭ�������ڼ��ȵ������·�Ӧ��������ͭ������ͭ��ϡ���ᷴӦ����������ͭ���÷�Ӧ�Ļ�ѧ����ʽΪ��![]() ��
��
![]() ��
��![]() ��
��![]() ���ɻ�ѧ����ʽ��֪����ȡͬ������������ͭ�������ĵ������٣����ҵ�ʵ�鷽������Ⱦ�����������������Ƚϻ����������ȡͬ����CuSO4�������ĵ�������٣���������Ⱦ����SO2��
���ɻ�ѧ����ʽ��֪����ȡͬ������������ͭ�������ĵ������٣����ҵ�ʵ�鷽������Ⱦ�����������������Ƚϻ����������ȡͬ����CuSO4�������ĵ�������٣���������Ⱦ����SO2��

����Ŀ����ͼ����������̽�����������ʡ�ʵ��ʱ��NaOH�����ϵμ���Ũ��ˮ����������������������һ������������档�±��ж�ʵ�����������Ľ�����ȷ���ǣ�������
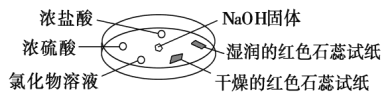
ѡ�� | ʵ������ | ���� |
�� | Ũ���ḽ���������� | NH3��HCl��Ӧ������NH4Cl���� |
�� | Ũ���ḽ������������ | NH3��Ũ���������Ӧ |
�� | �Ȼ�����Һ���к��ɫ���� | ����Һһ����FeCl3��Һ |
�� | ����ĺ�ɫʯ����ֽ����ɫ��ʪ��ĺ�ɫʯ����ֽ���� | NH3��һ�ֿ����Լ� |
A.�ڢۢ�
B.�٢ۢ�
C.�٢�
D.�ۢ�