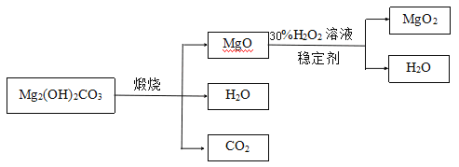
题目内容
【题目】某小组为探究碳酸钠的化学性质,如图所示,将四种物质分别加入到盛有碳酸钠溶液的试管中。请根据实验探究下列问题:
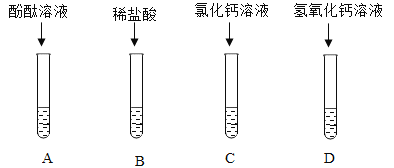
(1) A试管中溶液变红,说明碳酸钠溶液显___________(选填“酸性”、“碱性”或“中性”)。
(2) 写出B试管中发生反应的化学方程式______________。
(3)写出D试管中发生反应的化学方程式______________。
(4)实验结束后将A、B、C、D四只试管中的废液倒入同一只洁净的烧杯中,最终观察到烧杯底部有沉淀,上层为红色溶液。
[结论]上层溶液中一定不含①_____________(填离子符号), 理由是②______________。
[再探究]为探究上层溶液中含有哪些阴离子,帮助小组同学完成如下实验:
实验步骤 | 实验现象 | 实验结论 |
取溶液少许于试管中,加入足量的钙盐是_③_________ | 生成白色沉淀, 且溶液呈无色 | 则废液中一定含有的阴离子 是___________④(写离子符号) |
【答案】碱性 ![]()
![]() H+ 上层溶液显碱性,氢离子与氢氧根离子和碳酸钙沉淀不能共存 CaCl2溶液(或Ca( NO3)2) CO32-、Cl-
H+ 上层溶液显碱性,氢离子与氢氧根离子和碳酸钙沉淀不能共存 CaCl2溶液(或Ca( NO3)2) CO32-、Cl-
【解析】
结论:实验结束后将A、B、C、D四只试管中的废液倒入同一只洁净的烧杯中,最终观察到烧杯底部有沉淀,上层为红色溶液,说明上层溶液显碱性,且沉淀为碳酸钙沉淀。
再探究:试管B和试管C中稀盐酸和氯化钙中的氯离没有参加复分解反应,故实验结束后将A、B、C、D四只试管中的废液倒入同一只洁净的烧杯中,溶液中一定含有氯离子。
碳酸根离子可用可溶性钙盐、钡盐或酸来检验。
(1)碱性溶液能使无色的酚酞试液变红色,A试管中溶液变红,说明碳酸钠溶液显碱性;故填:碱性;
(2)碳酸钠与盐酸反应生成氯化钠、水和二氧化碳;故填:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(3)碳酸钠与氢氧化钙反应生成碳酸钙白色沉淀和氢氧化钠;故填:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(4)①实验结束后将A、B、C、D四只试管中的废液倒入同一只洁净的烧杯中,最终观察到烧杯底部有沉淀,上层为红色溶液,说明上层溶液显碱性,即含有氢氧根离子,而氢离子与氢氧根离子和碳酸钙沉淀不能共存,所以一定不含氢离子;故填:H+;上层溶液显碱性,氢离子与氢氧根离子和碳酸钙沉淀不能共存;
③废液中一定含有氯离子,实验中加入钙盐检验的是碳酸根离子,此钙盐可以是氯化钙溶液或硝酸钙溶液,钙离子与碳酸根离子结合成碳酸钙白色沉淀,溶液无色说明没有氢氧根离子,故填:CaCl2溶液(或Ca( NO3)2溶液);CO32-、Cl-。