题目内容
【题目】请用所学知识回答下列问题:
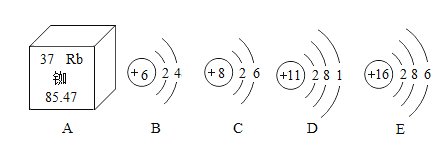
(1)我国的北斗导航卫星系统采用铷原子钟,提供精确时间。从图A可知,铷原子的质子数为_____,其中子数和质子数之差约为_____。
(2)B~E是四种粒子的结构示意图,D在化学反应中易_____电子(填“得”或“失”);其中与E化学性质相似的粒子是_____(填字母)。
(3)元素D和E形成的化合物的化学式为_____。
【答案】37 11 失 C Na2S
【解析】
(1)根据元素信息可知,铷的质子数为37。在原子中,质子数+中子数≈相对原子质量,则铷的中子数为:85.47-37=48.47,则中子数和质子数相差:48.47-37≈11。故答案为:37、11;
(2)D的最外层电子数是1,在化学反应中易失去1个电子,形成8电子稳定结构。E的最外层电子数为6,C的最外层电子数也为6,最外层电子数相同,两种元素的化学性质相似。故答案为:失、C;
(3)元素D是钠元素,元素E是硫元素。钠元素易失去1个电子,形成Na+,硫元素易得到2个电子,形成S2-。形成的化合物为硫化钠,Na2S。故答案为:Na2S。

 名校课堂系列答案
名校课堂系列答案【题目】某小组为探究碳酸钠的化学性质,如图所示,将四种物质分别加入到盛有碳酸钠溶液的试管中。请根据实验探究下列问题:
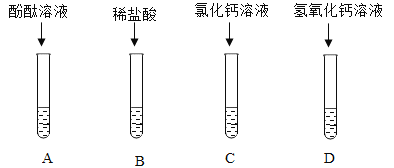
(1) A试管中溶液变红,说明碳酸钠溶液显___________(选填“酸性”、“碱性”或“中性”)。
(2) 写出B试管中发生反应的化学方程式______________。
(3)写出D试管中发生反应的化学方程式______________。
(4)实验结束后将A、B、C、D四只试管中的废液倒入同一只洁净的烧杯中,最终观察到烧杯底部有沉淀,上层为红色溶液。
[结论]上层溶液中一定不含①_____________(填离子符号), 理由是②______________。
[再探究]为探究上层溶液中含有哪些阴离子,帮助小组同学完成如下实验:
实验步骤 | 实验现象 | 实验结论 |
取溶液少许于试管中,加入足量的钙盐是_③_________ | 生成白色沉淀, 且溶液呈无色 | 则废液中一定含有的阴离子 是___________④(写离子符号) |
【题目】每年的 CES(国际消费类电子产品展览会)都会有一大波“黑科技”产品发布, 而这些产品大多是由金属材料制成,铜是其中重要的金属材料。
I.自然界中的铜主要以化合物形式存在于铜矿石中,从“绿色化学”的理念分析,以下铜矿最适宜炼铜的是_____(填序号)
A 黄铜矿(CuFeS2) B 辉铜矿(Cu2S)
C 蓝铜矿 [Cu(OH)2(CO3)2 ] D 斑铜矿(Cu5FeS4)
II.某化学兴趣小组用如下实验装置制取一氧化碳,再用一氧化碳还原氧化铜模拟炼铜。
(查阅资料)
(1)实验室常用甲酸(H2CO2)和浓硫酸混合加热制备 CO,同时生成 H2O。
(2)浓硫酸具有吸水性。
(进行实验)小组同学组装好下图装置并检查装置气密性之后开始实验,先让 A 装置反应一会儿,然后熄灭 A 中的酒精灯,再点燃 C 装置中的酒精灯。
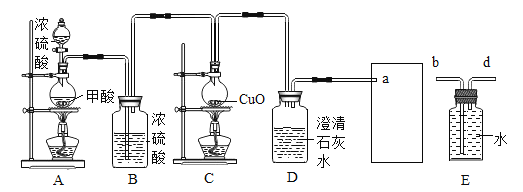
(1)装置 B 的作用是_____;装置 C 中发生反应的化学方程式是_____。
(2)装置 D 的作用是_____;该装置的组装存在的错误是_____; 改正之后,该装置中发生反应的化学方程式是_____。
(3)为避免一氧化碳污染空气,回收利用一氧化碳,方框中应连接装置 E,与 a 导管接口相接的是_____(填“b”或“d”)。
(4)实验结束之后,得到带有金属光泽的砖红色粉末,小组决定对该固体的成分进行探究。
(提出问题)红色的固体是什么?
(查阅资料)氧化亚铜(Cu2O)是红色粉末状固体;
会与稀硫酸反应:Cu2O + H2SO4 == CuSO4 + Cu + H2O。
(提出猜想)猜想一:该固体全部为 Cu;
猜想二:该固体全部为 Cu2O;
猜想三:该固体为 Cu2O 和 Cu 的混合物。
(实验方案)
实验步骤 | 实验现象及实验结论 |
取少量固体粉末于试管中, 加入过量_____溶液。 | 若无明显变化,则猜想一成立; 若溶液变为_____色,则猜想二或猜想三成立。 |
为了进一步确定混合物的组成,另取 m g 固体,重复上述实验,然后将反应后的物质过滤、洗涤、干燥,再次称量得到 n g 固体,若 m 和 n 满足_____的量的关系,则 猜想三成立。
(得出结论)该固体为 Cu2O 和 Cu 的混合物。
(交流讨论)
(1)从实验安全的角度考虑,本实验存在的危险是_____,改进的方法是_____;
(2)从物质的转化程度考虑,小组同学针对如何将氧化铜全部转化为铜单质展开讨论, 查阅了大量资料之后知道,反应条件是影响生成物的重要因素,因此一致认为在下次实验中需要适当加大 CO 的通入量或者_____。