��Ŀ����
����Ŀ������ͼ1��2��ʾ��Ϣ���ش�������⡣
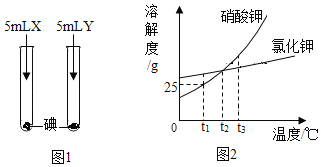
(1)ͼ1��ʾʵ�飬X��Y�ֱ���ˮ�������е�һ�֣�ʵ���й۲쵽:����X�������ʧ���õ���ɫ��Һ������Y�����δ��ʧ����X��_______________����ʵ���֪�����ʵ��ܽ�����________________�йء�
(2)ͼ2Ϊ����غ��Ȼ��ص��ܽ�����ߣ���:
��t1��Cʱ������ص��ܽ��Ϊ_________________________��
��t1��Cʱ����20g����ؼ��뵽50gˮ�У�����ܽ��������Һ�����ʵ���������Ϊ__________________��
��t2��Cʱ���Ȼ��صı�����Һ�к�����������أ��ᴿ�Ȼ��صķ�����_________________________��
�ܽ�t3��Cʱ����ء������صı�����Һ��100g �ֱ�����10gˮ��Ȼ������t2��C�����ˣ��õ��������Һa���Ȼ�����Һb��������Һa����Һb������˵����ȷ����__________________________��
A ���DZ�����Һ
B ��������a=b
C ���ʵ���������a=b
D ��Һ����a<b
E �ܼ�����a<b
���𰸡����� �ܼ������� 25g 20% �����ᾧ ACDE
��������
��1��ͼ1��ʾʵ�飬X��Y�ֱ���ˮ�������е�һ�֣�ʵ���й۲쵽������X�������ʧ���õ���ɫ��Һ������Y�����δ��ʧ�����ڵ������ھƾ������ͣ�������ˮ����X�����ͣ���ʵ���֪�����ʵ��ܽ������ܼ��������йأ��ʴ�Ϊ�����ͣ��ܼ������ʣ�
��2����t1��ʱ������ص��ܽ��Ϊ25g��
��t1��ʱ������ص��ܽ��Ϊ25g����100gˮ���������25g����أ���20g����ؼ��뵽50gˮ�У�����ܽ���ܽ�����ص�����Ϊ12.5g��������Һ�����ʵ���������![]() ��
��
��t2��ʱ���Ȼ��صı�����Һ�к�����������أ��ᴿ�Ȼ��صķ����������ᾧ����Ϊ�Ȼ��ص��ܽ�����¶ȵ�Ӱ��仯����
��A ������ʱ���Ȼ��غ�����صı�����Һ�����ܽ�ȱ�С���������壬���ö��DZ�����Һ��ѡ����ȷ��
B�� t3��ʱ������ص��ܽ�ȱ��Ȼ��صĴ�100g������Һ���������Һ���ܼ����Ȼ�����Һ�е��ܼ��٣��ֱ�����10gˮ����Ȼ���������Һ���ܼ����Ȼ�����Һ���١�������t2��C������غ��Ȼ��ص��ܽ����ͬ���������ʵĶ��پ������ܼ��Ķ��٣���������a<b��ѡ�����
C ��![]() ��������t2��C���Ȼ��غ���������ö��DZ�����Һ�����ܽ����ͬ�����ʵ���������a=b��ѡ����ȷ��
��������t2��C���Ȼ��غ���������ö��DZ�����Һ�����ܽ����ͬ�����ʵ���������a=b��ѡ����ȷ��
D����������ص��ܽ�����¶�Ӱ�����ʱ����������Ȼ��صĶ࣬����ʣ����Һ����a<b��ѡ����ȷ��
E��t3��ʱ������ص��ܽ�ȱ��Ȼ��صĴ�100g������Һ���������Һ���ܼ����Ȼ�����Һ�е��ܼ��٣��ֱ�����10gˮ����Ȼ���������Һ���ܼ����Ȼ�����Һ���١����ܼ�����a<b��ѡ����ȷ��
�ʴ�Ϊ����25g����20%���������ᾧ����ACDE��

����Ŀ������ʵ������������й���̽��������ijЩ�������ʺͻ�ѧ���ʵ����⣬������ǯ��ȡ��ĥ����ͭƬ�ھƾ����ϼ��ȣ�����ͭƬ�����ڣ�Ϊ��̽����ɫ���ʵijɷ֡�
���������ϣ���1��ͭ����������Ҫ�����֣�CuO����ɫ����Cu2O����ɫ��
��2���ƾ��ڲ���ȫȼ��ʱ�����̿��
��3��̿�ڲ���ϡ���ᷴӦ��Ҳ������ϡ�������ͭ����ϡ���ᷴӦ���ܽ�
��������裩����1����ɫ����Ϊ_____________��
����2����ɫ����Ϊ̿�ڡ�
����3����ɫ����Ϊ_____________��
����Ʒ�����
�������� | ʵ���п��ܳ��ֵ����� | ʵ����� |
ȡ������ɫ�������Թ��У����� ����___________�����������ƣ� | ��_______ | ����1���� |
�� ��ɫ����û�м��٣���Һ��ɫ���� | ����2���� | |
��_______ | ����3���� |
���ó����ۣ�ͨ��ʵ�����ó�����3�������˺�ɫ����Ϊ������д��ʵ���з����Ļ�ѧ����ʽ____________��
����Ŀ��ijС��Ϊ̽��̼���ƵĻ�ѧ���ʣ���ͼ��ʾ�����������ʷֱ���뵽ʢ��̼������Һ���Թ��С������ʵ��̽����������:
(1) A�Թ�����Һ��죬˵��̼������Һ��___________(ѡ����ԡ��������ԡ������ԡ�)��
(2) д��B�Թ��з�����Ӧ�Ļ�ѧ����ʽ______________��
(3)д��D�Թ��з�����Ӧ�Ļ�ѧ����ʽ______________��
(4)ʵ�������A��B��C��D��ֻ�Թ��еķ�Һ����ͬһֻ�ྻ���ձ��У����չ۲쵽�ձ��ײ��г������ϲ�Ϊ��ɫ��Һ��
[����]�ϲ���Һ��һ��������_____________(�����ӷ���)�� �����Ǣ�______________��
[��̽��]Ϊ̽���ϲ���Һ�к�����Щ�����ӣ�����С��ͬѧ�������ʵ��:
ʵ�鲽�� | ʵ������ | ʵ����� |
ȡ��Һ�������Թ��У����������ĸ�����_��_________ | ���ɰ�ɫ������ ����Һ����ɫ | ���Һ��һ�����е������� ��___________��(д���ӷ���) |
����Ŀ����ѧ������ϢϢ��أ��±�Ϊ��������Ӫ���ɷ�
Ӫ���� | ÿ�ݺ��� |
��֬ | 23.5g |
���� | 104.7g |
���� | 3.5g |
�� | 814mg |
�� | 130mg |
ˮ | С��210g |
��1����������һ�ֿ��ʳƷ���������ͼ������Ϣ���ش��������⣺

���ӱ��С���������Ӫ���ɷ֡�����û�б������������Ӫ������_____��
��ͼ1ͼ2�İ�װ����һ���Ƿ�����������������������ѹ�Ƴ�������˵�����������õ�_____��
���������������÷��Ȱ��е���ʯ����ˮ��Ӧ�ų����������м��ȣ���ʯ����ˮ��Ӧ�Ļ�ѧ����ʽΪ_____��
��2�����õļҾӻ����������õ����
������װ�������ڷ�һЩ����̿������װ�����ͷų��ļ�ȩ�������ж����壬�������û���̿��_____�ԣ�
����ͼ3��������Ϩ����һ�����͵ļ��������Ʒ��������Ϩ���Ӵ�������3��5���ը�����ͷŵķ�ĩ������ȼ�����ϣ�ͬʱ�ų�����ȼ�����壬ʹ����Ϩ�𣮡�����Ϩ�������ԭ����_____������ĸ��ţ���
A �����ȼ�� B ʹȼ�������������� C ����ȼ������Ż�㣮
����Ŀ��ÿ��� CES��������������Ӳ�Ʒչ���ᣩ������һ���ڿƼ�����Ʒ������ ����Щ��Ʒ������ɽ��������Ƴɣ�ͭ��������Ҫ�Ľ������ϡ�
I.��Ȼ���е�ͭ��Ҫ�Ի�������ʽ������ͭ��ʯ�У��ӡ���ɫ��ѧ�����������������ͭ����������ͭ����_____������ţ�
A ��ͭ��CuFeS2�� B ��ͭ��Cu2S��
C ��ͭ�� [Cu��OH��2��CO3��2 ] D ��ͭ��Cu5FeS4��
II.ij��ѧ��ȤС��������ʵ��װ����ȡһ����̼������һ����̼��ԭ����ͭģ����ͭ��
���������ϣ�
��1��ʵ���ҳ��ü��ᣨH2CO2����Ũ�����ϼ����Ʊ� CO��ͬʱ���� H2O��
��2��Ũ���������ˮ�ԡ�
������ʵ�飩С��ͬѧ��װ����ͼװ�ò����װ��������֮��ʼʵ�飬���� A װ�÷�Ӧһ�����Ȼ��Ϩ�� A �еľƾ��ƣ��ٵ�ȼ C װ���еľƾ��ơ�
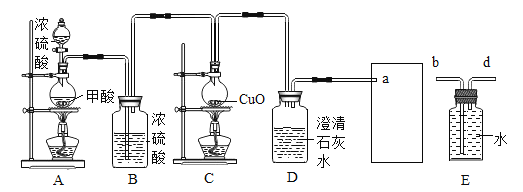
��1��װ�� B ��������_____��װ�� C �з�����Ӧ�Ļ�ѧ����ʽ��_____��
��2��װ�� D ��������_____����װ�õ���װ���ڵĴ�����_____�� ����֮��װ���з�����Ӧ�Ļ�ѧ����ʽ��_____��
��3��Ϊ����һ����̼��Ⱦ��������������һ����̼��������Ӧ����װ�� E���� a ���ܽӿ���ӵ���_____���b����d������
��4��ʵ�����֮�õ����н��������ש��ɫ��ĩ��С������Ըù���ijɷֽ���̽����
��������⣩��ɫ�Ĺ�����ʲô��
���������ϣ�������ͭ��Cu2O���Ǻ�ɫ��ĩ״���壻
����ϡ���ᷴӦ��Cu2O + H2SO4 == CuSO4 + Cu + H2O��
��������룩����һ���ù���ȫ��Ϊ Cu��
��������ù���ȫ��Ϊ Cu2O��
���������ù���Ϊ Cu2O �� Cu �Ļ���
��ʵ�鷽����
ʵ�鲽�� | ʵ������ʵ����� |
ȡ���������ĩ���Թ��У� �������_____��Һ�� | �������Ա仯�������һ������ ����Һ��Ϊ_____ɫ��������������������� |
Ϊ�˽�һ��ȷ����������ɣ���ȡ m g ���壬�ظ�����ʵ�飬Ȼ��Ӧ������ʹ��ˡ�ϴ�ӡ�����ٴγ����õ� n g ���壬�� m �� n ����_____�����Ĺ�ϵ���� ������������
���ó����ۣ��ù���Ϊ Cu2O �� Cu �Ļ���
���������ۣ�
��1����ʵ�鰲ȫ�ĽǶȿ��ǣ���ʵ����ڵ�Σ����_____���Ľ��ķ�����_____��
��2�������ʵ�ת���̶ȿ��ǣ�С��ͬѧ�����ν�����ͭȫ��ת��Ϊͭ����չ�����ۣ� �����˴�������֮��֪������Ӧ������Ӱ�����������Ҫ���أ����һ����Ϊ���´�ʵ������Ҫ�ʵ��Ӵ� CO ��ͨ��������_____��