题目内容
(3分)现有一瓶纯碱样品其中含有少量NaCl杂质,课外化学小组同学将100g盐酸分5次加入到20g纯碱样品中,得到如下部分数据和图象(假设产生的气体全部逸出)。
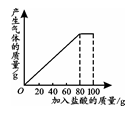
请计算:
(1)第2次加入盐酸后,a为___ ____g。
(2)16%的NaCl溶液可用于生物小组进行选种。欲将第5次实验后的溶液配成16%的NaCl溶液,可先向此溶液中加入适量的碳酸钠粉末,至无气泡产生为止,这时还需要向溶液中加入水多少克?(假设实验过程中溶液损失忽略不计)

| 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 20 | 20 | 20 |
| 烧杯中剩余物的质量/g | 38.24 | a | 74.72 |
(1)第2次加入盐酸后,a为___ ____g。
(2)16%的NaCl溶液可用于生物小组进行选种。欲将第5次实验后的溶液配成16%的NaCl溶液,可先向此溶液中加入适量的碳酸钠粉末,至无气泡产生为止,这时还需要向溶液中加入水多少克?(假设实验过程中溶液损失忽略不计)
(1)56.48g。 (2)49.81g
试题分析:(1)根据反应的图象可知,在加入80g稀盐酸时,即第4次加入稀盐酸后,恰好完全反应,因为此后的二氧化碳质量就不再改变,即再加稀盐酸也不再会反应放出二氧化碳了;因此,前四次实验中,稀盐酸都能全部充分反应;由此根据第1次反应的数据,可推知每加入20g稀盐酸,充分反应后产生二氧化碳的质量。即每加入20g稀盐酸会产生气体的质量为20g+20g-38.24g=1.76g,所以,第2次加入20g稀盐酸后,也会产生1.76g气体;则第2次加入20g稀盐酸后烧杯中剩余物的质量=20g+20g+20g-1.76g-1.76g=56.48g。
(2)根据表格数据计算出每反应掉20g稀盐酸所产生二氧化碳的质量为1.76g,利用化学方程式可计算出每20g稀盐酸可消耗Na2CO3质量和生成NaCl质量,注意第5次的盐酸没有反应,故需要加入和前四次反应相同量的碳酸钠来反应掉剩余的盐酸;然后计算第5次实验后氯化钠的总质量(原样品中的氯化钠和每次反应生成的氯化钠)以及溶液的总质量,据此计算16%的氯化钠溶液总质量与反应后所得氯化钠溶液质量差即为还需加水量。
解:每20克稀盐酸反应后产生二氧化碳的质量=20g+20g-38.24g=1.76g
设每20克稀盐酸可消耗Na2CO3质量为x ,生成NaCl质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
X y 1.76g
106:44=x:1.76g
117:44=y:1.76g
解得,x=4.24g,y=4.68g
则纯碱样品中的杂质NaCl的质量=20g-4.24g×4=3.04g
故所得溶液中NaCl总质量=4.68g×5+3.04g=26.44g
所得NaCl溶液总质量=20g+100g+4.24g-1.76g×5=115.44g
则16%的NaCl溶液的质量为26.44g÷16%=165.25g;
则需要加水质量为165.25g-115.44g=49.81g。
答:需要加水质量约为49.81g。
点评:此题是关于化学方程式及溶质质量分数的计算题,主要是利用图表及反应方程式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力;解题的关键是要明确所求溶液的溶质是什么,有几部分组成;然后根据相关的化学反应方程式,并依据已知量对未知的应求量进行求解计算即可,注意解题要规范。

练习册系列答案
相关题目

 2Fe + 3CO2
2Fe + 3CO2
 2NaOH+Cl2↑+H2↑。若制得40g氢氧化钠,同时可得到氢气的质量是多少?
2NaOH+Cl2↑+H2↑。若制得40g氢氧化钠,同时可得到氢气的质量是多少?