题目内容
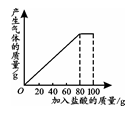
(3分)氯化钙钾石的化学式为KCl·xCaCl2(x是CaCl2的系数)。它是一种钾肥,溶于水后得到KCl和CaCl2的混合溶液。某化学兴趣小组为了测定氯化钙钾石中钾元素的质量分数,称取样品18.55g加水完全溶解得到KCl与CaCl2的混合溶液210g,向该溶液中逐滴加入Na2CO3溶液,产生的沉淀与加入Na2CO3溶液的质量关系如下图所示。
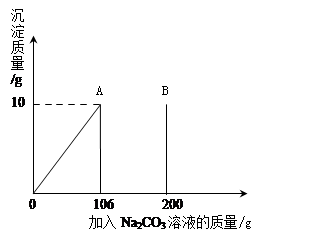
已知:Na2CO3 + CaCl2=CaCO3↓ + 2NaCl
请计算:
(1)氯化钙钾石中钾元素的质量分数。
(2)B点时溶液中Na2CO3的质量分数。
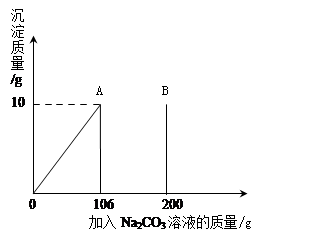
已知:Na2CO3 + CaCl2=CaCO3↓ + 2NaCl
请计算:
(1)氯化钙钾石中钾元素的质量分数。
(2)B点时溶液中Na2CO3的质量分数。
(1)21.0%;(2)2.4%
试题分析:由题意可得,当加入Na2CO3溶液106g时,碳酸钠和氯化钙恰好反应完全,此时生成碳酸钙沉淀10g。
【解】设CaCl2的质量为x,A点时参加反应的Na2CO3的质量为y
Na2CO3+ CaCl2 CaCO3+ 2NaCl
106 111 100
y x 10g
111:100=x:10g
x="11.1g"
106:100=y:10g
y="10.6g"
KCl的质量="18.55g-11.1g" = 7.45g
氯化钙钾石中钾元素的质量分数=
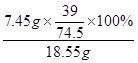 ×100% =" 21.0%"
×100% =" 21.0%" 所加Na2CO3溶液的质量分数=
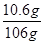 ×100%=10%
×100%=10%B点时的溶液中Na2CO3的质量分数=
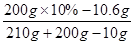 ×100% =" 2.4%"
×100% =" 2.4%" 答:氯化钙钾石中钾元素的质量分数为21.0% ,B点时溶液中Na2CO3的质量分数2.4%。
点评:根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。
溶液中溶质的质量分数=
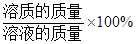

练习册系列答案
相关题目
 C(金刚石)+4NaCl。这项成果被科学家们评价为“稻草变黄金”。 若要制得1.2g金刚石粉末,求需要金属钠的质量。
C(金刚石)+4NaCl。这项成果被科学家们评价为“稻草变黄金”。 若要制得1.2g金刚石粉末,求需要金属钠的质量。 Mg + Cl2↑。某工厂要生产出120 t金属镁,至少需要电解氯化镁多少吨?
Mg + Cl2↑。某工厂要生产出120 t金属镁,至少需要电解氯化镁多少吨?