题目内容
现有Fe和Fe2O3的固体混合物,为了分析混合物中Fe和Fe2O3的含量,设计了如下实验方案:

【实验数据】实验共记录了两组实验数据,第①组,气体完全吸收后,石灰水溶液质量增加66g;第②组,完全反应,冷却后称量剩余固体的质量为Wg。
Fe2O3和CO反应方程式是:Fe2O3 + 3CO 2Fe + 3CO2
2Fe + 3CO2
根据实验设计及有关数据进行分析与计算
(1)生成气体的质量是 g。
(2)混合物中Fe单质的质量分数为多少?(写出计算过程)
(3)第②组数据W是 g(写出计算结果)。
(4)若在100g Fe和Fe2O3的固体混合物中持续不断的通入CO,请你画出固体质量与通入CO质量的关系图(在答题卡的坐标中作图)。

【实验数据】实验共记录了两组实验数据,第①组,气体完全吸收后,石灰水溶液质量增加66g;第②组,完全反应,冷却后称量剩余固体的质量为Wg。
Fe2O3和CO反应方程式是:Fe2O3 + 3CO
 2Fe + 3CO2
2Fe + 3CO2根据实验设计及有关数据进行分析与计算
(1)生成气体的质量是 g。
(2)混合物中Fe单质的质量分数为多少?(写出计算过程)
(3)第②组数据W是 g(写出计算结果)。
(4)若在100g Fe和Fe2O3的固体混合物中持续不断的通入CO,请你画出固体质量与通入CO质量的关系图(在答题卡的坐标中作图)。

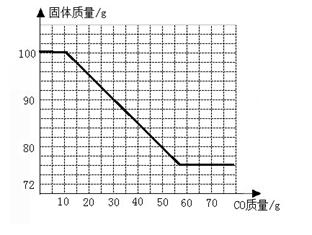
(1)66;(2)20%;(3)76;(4)

试题分析:(1)第①组反应生成的气体为二氧化碳,气体完全吸收后,石灰水溶液质量增加66g,所以生成气体的质量是66g;
(2)解:固体混合物中Fe2O3的质量为X。
Fe2O3 + 3CO
 2Fe + 3CO2
2Fe + 3CO2160 3×44
X 66g
160:X = 3×44:66g
解得 x= 80g
Fe单质的质量分数:(100g–80g)/100g×100% = 20%
答:混合物中铁单质的质量分数是20%。
(3)第二组数据W很明显是单质铁的,这个单质铁有两部分来源,一部分是原有的,一部分是被还原生成的,根据第二问可以计算出被还原的三氧化二铁的质量为80g,100g-80g=20g是原有的铁的质量,被还原生成的铁的质量也可通过化学方程式求出来为56g,所以W=20g+56g=76g。
(4)如图下图:
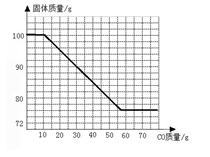
有两个平台,第一个平台的终点及第二个平台的起点不固定,但两个平台之间的水平差值大于42。
点评:此题较为灵活,考察了多方面的能力,尤其最后的作图题,要将所有的反应过程分析明白,明白量与量之间的关系。

练习册系列答案
相关题目