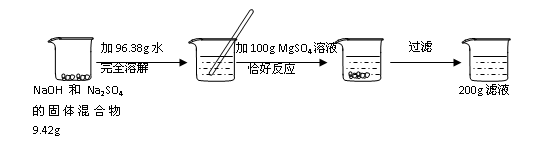
题目内容
(本小题共6分,其中⑴题2分,⑵题4分)
某化学兴趣小组为了测定某种生铁样品中铁的质量分数,在实验室将5.8g生铁样品放入烧杯中,加入50g稀硫酸恰好完全反应(杂质不参加反应),反应后称得剩余物质的总质量为55.6g。请回答:
⑴你分析后一定能计算出产生氢气的质量为 。你上述计算的理论依据是 。
⑵请你参与这个小组,来计算出该生铁样品中铁的质量分数是多少?(结果保留一位小数)
某化学兴趣小组为了测定某种生铁样品中铁的质量分数,在实验室将5.8g生铁样品放入烧杯中,加入50g稀硫酸恰好完全反应(杂质不参加反应),反应后称得剩余物质的总质量为55.6g。请回答:
⑴你分析后一定能计算出产生氢气的质量为 。你上述计算的理论依据是 。
⑵请你参与这个小组,来计算出该生铁样品中铁的质量分数是多少?(结果保留一位小数)
(本小题共6分,其中⑴题2分,⑵题4分)
(1) 0.2g (1分) 质量守恒定律 (1分)
⑵96.6%
(1) 0.2g (1分) 质量守恒定律 (1分)
⑵96.6%
试题分析:根据题意可知,样品中只有铁与稀硫酸反应生成氢气逸出,反应前后,剩余物质量减少的部分就是反应生成的氢气的质量。故有:
1、产生氢气的质量为:5.8+50-55.6=0.2g;
2、要计算样品中铁的质量分数,可以根据氢气的质量,依据化学方程式进行计算就可以了。故有:解:设生铁样品中铁的质量分数为x,则
Fe + H2SO4 = FeSO4 + H2↑ ┄ ┄ ┄ ┄ (1分)
56 2 ┄ ┄ ┄ ┄ (2分)
5.8x 0.2g
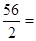
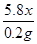 ┄ ┄ ┄ ┄ ┄ ┄(3分)
┄ ┄ ┄ ┄ ┄ ┄(3分)x=96.6% ┄ ┄ ┄ ┄ ┄ ┄ (4分)
答:生铁样品中铁的质量分数为96.6%。
点评:根据化学方程式计算要注意解题的步骤。

练习册系列答案
相关题目
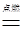 2HCl)
2HCl)