��Ŀ����
����Ŀ��Ϊ��̽���������Ļ�ѧ���ʣ�ij��ȤС���ͬѧ����������̽����
(1)���Ľ������
��ͬѧ����ĥ������Ƭ��������ͭ��Һ�У�������������_____��˵�����Ľ�����Ա�ͭ_____(����ǿ����������)��
(2)������ķ�Ӧ
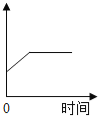
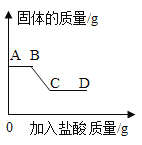
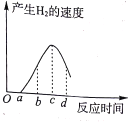
����Ƭ��ϡ���ᷴӦ�����������ٶ���ʱ��Ĺ�ϵ��ͼ��ʾ����Ӧ�����У��Թ���ڷ��̣�˵���÷�Ӧ��____(��������������������)��Ӧ��ͼ�д�c�㵽d�㷴Ӧ���ʱ�������Ҫԭ�������________��
�ڽ���С��ͬ����Ƭ��������Ũ����ͬ��������ϡ�����ϡ���ᷴӦ������������������ٶ�ǰ�߱Ⱥ������ܶ࣬��ͬѧ�Ա������������Ļ�ѧʽ����Ϊ��������Һ�е�_____(ѡ����H+����C1-������SO42-��)�Է�Ӧ�����˴ٽ����á�
(3)����ˮ�ķ�Ӧ
��������⣩���ܷ���ˮ��Ӧ��������?
���������ϣ��������Ȼ���(HgCl2)��Ӧ���γ�������(�����Ͻ�)�ƻ����������ܵ�����Ĥ�ҷ�ֹ���������ɡ�
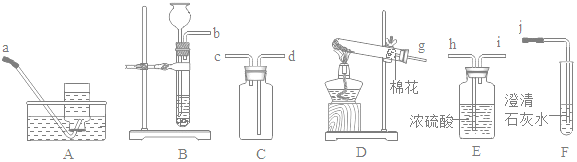
��ʵ��̽��������Ƭ��ȫ�����Ȼ���(HgCl2)��Һ��1min����ȡ������������ˮ��ϴ�ɾ�����뵽����ˮ��(��ͼ)����������ɴ������ݡ���Χ���ְ�ɫ�����������Ȼ�����Һ�����û���Ӧ�Ļ�ѧ����ʽΪ___���ڵ��ܿ�e��Ϳ����ˮ�����ֵ��ܿ��������γɣ��������뿪���ܺ�����_____(ѡ�����³�������������)����ȼ�ŵ�ľ����ȼ���ݣ�������������

��ʵ����ۣ�������ˮ��Ӧ����������
(4)��ͼ��������ˮ��Ӧ�Ĺ����У����رյ����ϵĻ���K����Ӧֹͣ����ԭ����___�����ٴδ���K����Ӧ�������������ݡ���δ����������������ԭ����_____��
���𰸡���Ƭ���渽���к�ɫ���ʣ���Һ����ɫ��Ϊ��ɫ�� ǿ�� ���ȣ� ��Һ�������ӵ�Ũ�����ͣ����Է�Ӧ���ʱ����� C1-�� 3HgCl2+2Al = 2AlCl3+3Hg�� ������ �رջ���K��������ѹǿ����Һ��ѹ���ձ���������Һ����룬��Ӧֹͣ�� �����ڳ��������������������Ӵ�
��������
(1) ��ͬѧ����ĥ������Ƭ��������ͭ��Һ�У������������ǣ���Ƭ���渽���к�ɫ���ʣ���Һ����ɫ��Ϊ��ɫ��˵�����Ľ�����Ա�ͭǿ��
(2) �ٷ�Ӧ�����У��Թ���ڷ��̣�˵���÷�Ӧ�Ƿ��ȷ�Ӧ��ͼ�д�c�㵽d�㷴Ӧ���ʱ�������Ҫԭ������ǣ����ŷ�Ӧ�Ľ��У���Һ�������ӵ�Ũ�����ͣ����Է�Ӧ���ʱ�����
������������о����������ӣ���������Ũ����ͬ��������ͬ���������Ӻ���������ӣ�������������С��ͬ����Ƭ��Ӧ�����������ٶȿ죬˵����������Һ�е�C1-�Է�Ӧ�����˴ٽ����ã�
(3)[ ʵ��̽��] �����Ȼ�����Һ��Ӧ���ɹ����Ȼ�������Ӧ�Ļ�ѧ����ʽΪ��3HgCl2+2Al = 2AlCl3+3Hg���ڵ��ܿ�e��Ϳ����ˮ�����ֵ��ܿ��������γɣ��������뿪���ܺ�������������ȼ�ŵ�ľ����ȼ���ݣ�������������
(4)������ˮ��Ӧ�Ĺ����У����رյ����ϵĻ���K����Ӧֹͣ����ԭ���ǣ��رջ���K��������ѹǿ����Һ��ѹ���ձ���������Һ����룬��Ӧֹͣ�����ٴδ���K����Ӧ�������������ݣ���δ����������������ԭ���ǣ������ڳ��������������������Ӵ���

 �����Ծ���Ԫ���Ծ�ϵ�д�
�����Ծ���Ԫ���Ծ�ϵ�д�