题目内容
【题目】有一瓶固体混合物样品,可能含氢氧化钠、氯化钠、硫酸钠、碳酸钠中的一种或几种。小敏同学为了探究其成分做了以下实验:
Ⅰ.取少量固体样品于烧杯中,先加足量水溶解,再加入足量的BaC12 溶液,有白色沉淀产生;
Ⅱ.继续向烧杯中逐滴加入稀盐酸并不断搅拌,烧杯内白色沉淀质量随加入稀盐酸质量的变化如图所示。请回答下列问题:
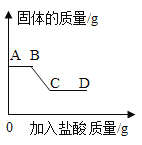
(1)AB 段发生反应的化学方程式:_____;
(2)D 点溶液中含有的溶质:_____。
【答案】NaOH+HCl=NaCl+H2O HCl、NaCl
【解析】
碳酸钠和氯化钡反应生成溶于酸的碳酸钡沉淀,硫酸钠和氯化钡反应生成不溶于酸的硫酸钡沉淀,取少量固体样品于烧杯中,先加足量水溶解,再加入足量的BaC12 溶液,有白色沉淀产生,所以样品中一定含有碳酸钠、硫酸钠中的一种或两种;
继续向烧杯中逐滴加入稀盐酸并不断搅拌,开始时,沉淀质量不变,所以样品中一定含有氢氧化钠,然后烧杯内白色沉淀质量随加入稀盐酸质量增加而逐渐减小,所以样品中一定含有碳酸钠和硫酸钠。
由分析可知(1)AB 段发生的反应是氢氧化钠和盐酸反应生成氯化钠和水,化学方程式为:NaOH+HCl=NaCl+H2O;
(2)D点溶液中含有的溶质:HCl、NaCl。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目