题目内容
【题目】内蒙古盐湖冬天洗出的碱(碳酸钠)中含有氯化钠,为了测定析出的碱中碳酸钠的含量,将同一瓶稀盐酸分两次倒入杯中,做如下实验。

请回答下列问题:
(1)实验中发生反应的化学方程式是______________________________;
(2)求解碱中碳酸钠质量(X)的比例式是_________________________;
(3)11g碱中碳酸钠的质量是_______g;
(4)实验时,所用稀盐酸的质量分数是_______________。
【答案】Na2CO3+2HCl===2NaCl+H2O+CO2↑ ![]() 10.6g 21.9%
10.6g 21.9%
【解析】
(1)碳酸钠与稀盐酸发生复分解反应,生成氯化钠、水和二氧化碳,反应方程式为:Na2CO3+2HCl===2NaCl+H2O+CO2↑;
(2)第一次加入25g稀盐酸,生成二氧化碳气体的质量为:11g+25g-32.7g=3.3g,第二次加入25g稀盐酸,生成二氧化碳气体的质量为:32.7g+25g-56.6g=1.1g,可知第一次加入稀盐酸不足量、碳酸钠有剩余,第二次加入的稀盐酸有剩余、碳酸钠完全反应,计算碳酸钠的量应按最终产生气体的质量计算。生成二氧化碳气体的总质量为4.4g,设碱中碳酸钠质量为X,
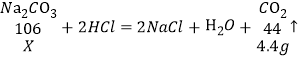
故碱中碳酸钠质量(X)的比例式是:![]()
(3)根据比例式![]() ,X=10.6g
,X=10.6g
(4)第一次加入的稀盐酸反应完全,第二次加入的稀盐酸有剩余,故按第一次进行计算,第一次反应生成二氧化碳质量为3.3g,设25g稀盐酸中溶质的质量分数为y,
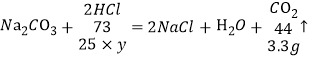
![]() , 解得y=21.9%
, 解得y=21.9%

练习册系列答案
相关题目