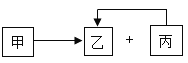题目内容
【题目】实验室需要配制11%的氯化钠溶液50g常按以下操作顺序进行。请回答下列问题:
(1)计算:需要氯化钠的质量为_______,需水的体积为_______;
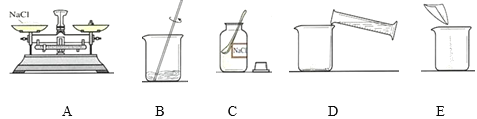
(2)C中盛放氯化钠固体的仪器名称是_______,在量取水的操作中,当水面接近所需刻度时,应使用______添加水。用上图所示的序号表示正确配制该溶液的操作顺序为_________。
(3)用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应______。
A.增加适量氯化钠固体 B.减少适量氯化钠固体
C.调节游码 D.添加砝码
(4)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是 _____。
(5)若在操作中将氯化钠放在右盘,砝码放在左盘,(1g以下用游码),则实际称量氯化钠的质量为____,那么所配制得氯化钠的溶质质量分数会____(填“偏小”“偏大”“不变”)。
(6)在上述配制的50g11%的氯化钠溶液中加入50g15%的氯化钠溶液后,所得溶液溶质的质量分数为______。
【答案】5.5克 44.5ml 广口瓶 胶头滴管 CAEDB B 加速氯化钠的溶解 4.5g 偏小 13%
【解析】
(1)配制溶液时所需氯化钠的质量为:50g×11%=5.5g,水的质量为:50g-5.5g=44.5g,由密度公式可得水的体积为44.5mL;
(2)用于盛放固体药品的是广口瓶;用量筒取水,当水接近所需刻度时,应用滴管加水至所需刻度;配制溶质质量分数一定的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解;
(3)用托盘天平称量所需的氯化钠时,先将砝码和游码放好后然后加药品,当发现托盘天平的指针偏向左盘,是药品过量,此时应该减少药品的质量;
(4)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是加速溶解;
(5)配制溶液时所需氯化钠的质量为5.5g,称量需使用5g的砝码,将游码拨到0.5g刻度处,由左盘质量=右盘质量+游码质量,则5g=氯化钠的质量+0.5g,可得实际称得氯化钠的质量为4.5g,故该学生配制的NaCl溶液的质量分数实际是![]() ×100%=9.2%,质量分数偏小;
×100%=9.2%,质量分数偏小;
(6)在上述配制的50g11%的氯化钠溶液中加入50g15%的氯化钠溶液后,所得溶液溶质的质量分数为![]() ×100%=13%。
×100%=13%。

 53随堂测系列答案
53随堂测系列答案【题目】某白色固体可能含有Na2CO3、Na2SO4、NaOH、Ba(NO3)2中的一种或几种.进行如下实验:(已知氯化钡溶液呈中性)
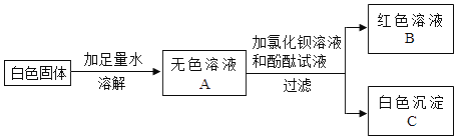
(1)在白色沉淀C中加入________,有气泡产生,沉淀全部溶解.根据上述实验分析,原白色固体中一定有________,一定没有________。
(2)为进一步确定白色固体中可能存在的物质,对红色溶液B进行实验,完成下表.
实验操作 | 实验现象 | 分析与结论 |
取少量红色溶液于试管中,加入 ________(限用一种试剂) | ________ | 原白色中固体有氢氧化钠 |
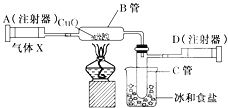
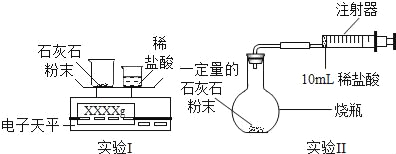
【题目】某校学习小组准备探究气体的测定和数据处理方法。
(提出问题)
如何利用石灰石(主要成分为CaCO3)与稀盐酸反应来测定生成CO2的质量和体积,并处理数据。
(实验设计)通过下列两个实验分别测定CO2的质量和体积:
(分析与表达)
(1)上述两个实验中,反应的化学方程式是_____。
(2)实验Ⅰ中,将小烧杯中的所有稀盐酸分几次加入到大烧杯中,并不断搅拌,判断石灰石中CaCO3完全反应的实验现象是_____。
(3)实验Ⅱ中,先连接好装置,再_____(填操作名称),然后装好药品,最后将10ml稀盐酸快速推入烧瓶中。若稀盐酸是缓慢推入的,则可能造成的后果是
_____。
(记录与处理)
(4)已知实验I反应前的总质量[m(大烧杯+石灰石粉末)+m(小烧杯+稀盐酸)],要计算生成CO2的质量,至少还需要的数据是_____。
A m(小烧杯) B m(大烧杯) C m(大烧杯+反应后剩余物)
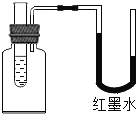
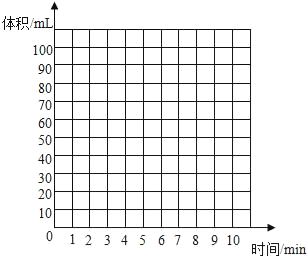
(5)实验Ⅱ的实验记录如下(表中数据在相同温度、相同压强条件下测定):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
注射器读数/ml | 60.0 | 85.0 | 88.0 | 89.0 | 89.5 | 89.8 | 89.9 | 90.0 | 90.0 | 90.0 |
①根据以上实验过程和数据综合分析,最终生成CO2的体积是_____mL,理由是_____。
②根据你的认识,在坐标图中绘制出0~10min生成CO2体积随时间变化的曲线。
(反思与评价)
(6)经过分析,你认为实验I的优点是_____,实验Ⅱ的优点是_____。