题目内容
【题目】人教版化学教材第三单元有一探究实验“分子的运动”,该实验需要用到一种化学药品:浓氨水,但实验室没有该药品。于是化学老师决定用加热氯化铵和氢氧化钙固体混合物的方法制取一种密度比空气小的气体:氨气,然后用制得的氨气常温下与水反应制得浓氨水,请回答下列问题:
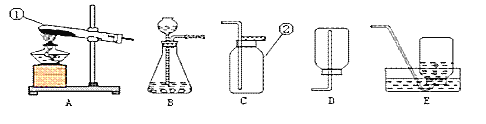
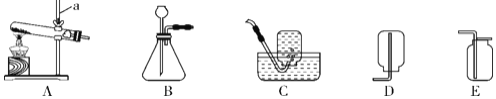
(1)写出指定仪器的名称:② ______________________。
(2)老师选择制取氨气的发生装置是(填序号,下同)_______,收集装置是_____
(3)同学们认为用制取氨气的装置也可以用于实验室制取氧气,则他们选择的药品是___,
该反应的原理是(写文字表达式)_____,若同学们想收集一瓶纯净的氧气,则选择的装置是__________
(4)小亮对铁丝在氧气中燃烧为什么会火星四射进行探究.下表是他将纯镁条和不同含碳量的铁丝(镁条和铁丝直径均为![]() )放入氧气中燃烧时的实验现象的记录.请你分析回答:
)放入氧气中燃烧时的实验现象的记录.请你分析回答:
物质 | 镁条 | 含碳 | 含碳 | 含碳 |
燃烧时 的现象 | 剧烈燃烧,发出 耀眼白光,无火星 | 剧烈燃烧 极少火星 | 剧烈燃烧 少量火星 | 未填 |
①表中“未填”部分的内容应为________;
②通过以上探究,你认为铁丝燃烧产生火星四射现象的原因可能是________.
③实验结束后,小亮同学发现集气瓶底破裂,则可能的原因是_______
【答案】集气瓶A D高锰酸钾(或者“氯酸钾和二氧化锰”) 高锰酸钾![]() 锰酸钾+二氧化锰+氧气 (或氯酸钾
锰酸钾+二氧化锰+氧气 (或氯酸钾![]() 氯化钾+氧气)E剧烈燃烧,火星四射铁丝中含碳量大于等于0.6%集气瓶底没有铺一层细沙或者少量水
氯化钾+氧气)E剧烈燃烧,火星四射铁丝中含碳量大于等于0.6%集气瓶底没有铺一层细沙或者少量水
【解析】
(1)据图可知仪器②是集气瓶;
(2)实验室制取氨气的原理是氯化铵和氢氧化钙固体混合共热制取,故反应装置选固体加热型装置A;密度比空气小的气体,常温下与水反应制得浓氨水,只能用向下排空气法收集,应选用装置D;
(3)实验室加热固体药品实验室制取氧气,则选择的药品是:高锰酸钾(或者“氯酸钾和二氧化锰”);该反应的文字表达式:高锰酸钾![]() 锰酸钾+二氧化锰+氧气 (或氯酸钾
锰酸钾+二氧化锰+氧气 (或氯酸钾![]() 氯化钾+氧气);排水法收集的氧气比较纯净,应选用装置E;
氯化钾+氧气);排水法收集的氧气比较纯净,应选用装置E;
(4)①由前三项对比可知铁丝含碳量越高火星越多,所以未填内容应为:剧烈燃烧,火星四射;
②由以上探究可知:铁丝在氧气中燃烧产生火星的多少与含碳量有关,所以铁丝在氧气中燃烧产生火星四射现象的原因可能是铁丝中含碳量≥0.6%;
③集气瓶底部水铺一层细沙或者少量水的作用是防止高温熔化物溅落炸裂瓶底,实验时,集气瓶炸裂了,其可能的原因是集气瓶底没有铺一层细沙或者少量水。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案【题目】取20g碳酸钠和碳酸氢钠的固体混合物,加热至不再产生气体2NaHCO3![]() Na2CO3+H2O+CO2↑),使生成的水完全被浓硫酸吸收,测得加热时间和浓硫酸质量增加的关系如表:
Na2CO3+H2O+CO2↑),使生成的水完全被浓硫酸吸收,测得加热时间和浓硫酸质量增加的关系如表:
时间 | 0分钟 | 1分钟 | 2分钟 | 3分钟 |
仪器和浓硫酸的质量总和(g) | 150 | 150.9 | 151.8 | 151.8 |
(1)当完全反应后,生成水的质量为_____g。
(2)计算混合物中碳酸氢钠的质量分数________。(要求写出计算过程)
(3)将上述混合物完全分解后的固体溶解于186.2g 水中,待固体完全溶解后所得溶液中溶质的质量分数为_____。