题目内容
【题目】过氧化钙(CaO2)是一种环境友好型供氧剂,可用于鱼类养殖、农作物栽培等,实验室有一瓶放置一段时间的过氧化钙样品,某兴趣小组对其成分展开了如下探究。
(查阅资料)CaO2能与水反应最终生成Ca(OH)2和O2;也能与CO2反应得到CaCO3和O2.过氧化氢溶液具有漂白性。
(提出问题)该固体样品的成分是什么?
(猜想假设)可能是CaO2、Ca(OH)2、CaCO3中的一种或几种。
(实验探究)
实验编号 | 实验步骤 | 实验现象 |
① | 取少量样品于试管中,加入一定量的水,一段时间后,在试管口插入带火星的木条 | 得到浊液,有气泡产生,木条复燃 |
② | 另取少量样品于试管中,滴加适量的试剂X,并将产生的气体通入澄清石灰水 | 得到澄清溶液,有气泡产生,生成的气体使石灰水变浑浊 |
③ | 室温下,取①中上层清液,用pH试纸测定溶液的pH | pH约为12 |
(得出结论)
(1)由实验①②可知,白色固体中肯定有_____。
(2)实验②中所加试剂X可以是_____(填字母序号)。
A 稀硫酸 B 稀盐酸 C 水 D 氢氧化钠溶液
(3)根据实验③_____(填“能”或者“不能”)判断原固体样品中含有Ca(OH)2,理由是_____。
(反思交流)(4)过氧化钙敞口放置在空气中,最终会变质为_____(填化学式),原因是_____。
(改进实验)(5)该兴趣小组在老师指导下,用装置甲进行少量过氧化钙样品与足量水反应的实验,实验时加入过氧化钙样品与足量水,迅速密闭装置,开始测氧气浓度。滴入几滴酚酞试液,观察到三颈烧瓶中溶液先变红后慢慢褪色。620秒时,将气球内二氧化锰加入三颈烧瓶中,瓶内氧气浓度随反应时间变化如图乙。
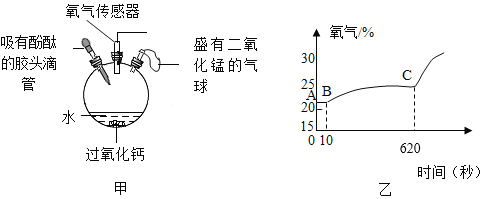
①AB段氧气浓度几乎不变的原因可能是_____;
②滴入酚酞试液后,三颈烧瓶中溶液变红后会慢慢褪色的原因可能是_____。
【答案】CaO2 和CaCO3 B 不能 样品中的过氧化钙能与水反应生成氢氧化钙 CaCO3 过氧化钙会与空气中的水蒸气反应生成氢氧化钙,氢氧化钙、过氧化钙均能与空气中的二氧化碳反应生成碳酸钙 过氧化钙与水反应先生成过氧化氢和氢氧化钙,没有生成氧气 生成氢氧化钙显碱性,使溶液变红,生成的过氧化氢具有漂白性,使溶液褪色
【解析】
(1)根据实验①中现象,产生使木条复燃的气体,说明生成氧气,则固体中一定有CaO2;根据实验②中现象,产生能使澄清石灰水变浑浊的气体,即生成二氧化碳,则原固体中一定有碳元素,可知固体中一定有CaCO3。由实验①②可知,白色固体中肯定有CaO2 和CaCO3。
(2)A、碳酸钙与稀硫酸反应生成的硫酸钙微溶于水,会覆盖在碳酸钙表面而阻止反应的进一步发生,故A错误;
B、碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,故B正确;
C、碳酸钙难溶于水,不与水反应,故C错误;
D、碳酸钙不与氢氧化钠溶液反应,故D错误。
故选B。
(3)室温下,取①中上层清液,用pH试纸测定溶液的pH约为12,显碱性,不能判断原固体样品中含有Ca(OH)2,因为过氧化钙与水反应生成氢氧化钙。
(4)过氧化钙与水反应生成氢氧化钙和氧气,过氧化钙与二氧化碳反应得到CaCO3和O2,氢氧化钙与空气中的二氧化碳反应生成碳酸钙和水,过氧化钙敞口放置在空气中,最终会变质为碳酸钙,化学式为:CaCO3。
(5)①过氧化钙与水反应先生成过氧化氢和氢氧化钙,过氧化氢在二氧化锰作催化剂时产生氧气,所以AB段氧气浓度几乎不变。
②氢氧化钙溶液显碱性,能使无色酚酞变红,但过氧化氢溶液具有漂白性,故滴入酚酞试液后,三颈烧瓶中溶液变红后会慢慢褪色。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】小宇为了测定实验室中氯酸钾样品的纯度,取10g样品与1g二氧化锰混合,依次加热该混合物t1、t2、t3、t4时间后,分别冷却称量剩余固体质量,记录的有关数据如下表(样品中的杂质不参与化学反应)
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量(g) | 9.68 | 9.04 | 7.16 | 7.16 |
试计算:
(1)完全反应后产生的氧气的总质量为_____________g;
(2)样品中氯酸钾的纯度是____(写出计算过程)
(3)加热时间t1后,9.68g剩余固体中除杂质外还含有的物质为_____________。