��Ŀ����
����Ŀ���ϳɰ��������ѧ�����ϵ�һ���ش�ͻ�ƣ�����ᷢչ��Ƽ����������˾��ס��ϳɰ����յ���Ҫ�������£�
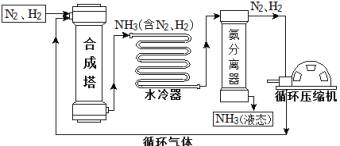
��1���ϳ����еķ�Ӧ�����ڸ��¡���ѹ�����������½��У��÷�Ӧ�Ļ�ѧ����ʽ�ǣ�_______������________���������Ӧ���ͣ���Ӧ��
��2�����������дӺϳ������������������______����������������
��3�����������п��ظ�ѭ��ʹ�õ�������________��
��4�����ݱ��е����ݻش����⡣
���� | H2 | N2 | O2 | NH3 |
�е�/�棨1.01��105 Pa�� | �C252 | �C195.8 | �C183 | �C33.35 |
��1.01��105 Paʱ������NH3��N2��H2���룬��ý��¶ȿ�����________�� ֮�䡣
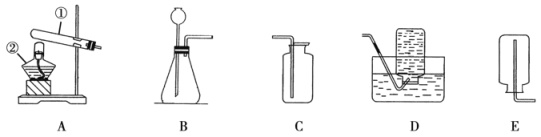
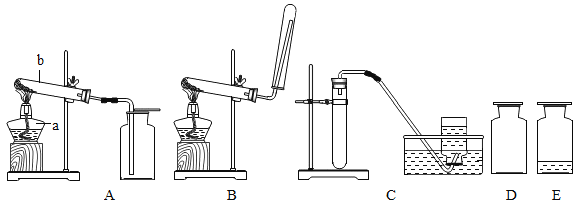
��5��1909�꣬��ѧ�ҹ����õ����������ڸ��¸�ѹ�������״κϳ��˰�������Ӧԭ����N2+3H2 ![]() 2NH3��������������ģ��ͼ��ʾ�ϳɰ����Ĺ��̣���ӷ�Ӧ��ʼ����ɵ�����˳��Ϊ_______������ĸ��ʾ����
2NH3��������������ģ��ͼ��ʾ�ϳɰ����Ĺ��̣���ӷ�Ӧ��ʼ����ɵ�����˳��Ϊ_______������ĸ��ʾ����
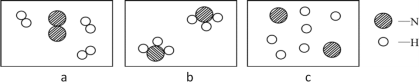
���𰸡� ���Ϸ�Ӧ ����� N2��H2 -195.8����-33.35�� a c b
���Ϸ�Ӧ ����� N2��H2 -195.8����-33.35�� a c b
��������
(1)�����������ڸ�������ѹ�ʹ������ィϼ��Ӧ���ɰ������ʻ�ѧ����ʽдΪ�� ��
��
�÷�Ӧ���������ʷ�Ӧ����һ�����ʣ���Ӧ����Ϊ���Ϸ�Ӧ������Ϸ�Ӧ��
��2����Ϊ�����л��е������������������������дӺϳ�����������������ڻ�������������
��3����Ӧ���������е��������������Ե�������������ѭ����������ѧʽ�ֱ�ΪN2��H2������N2��H2��
��4���ɱ������ݿ�֪����1.01��105Paʱ������NH3��N2��H2���룬��ý��¶ȿ����ک�33.35����195.8֮�䣬��ʱ����ΪҺ�壬����������������������-195.8����-33.35�档
��5���ڻ�ѧ��Ӧ�У������ȷ�Ϊԭ�ӣ�ԭ����������Ϲ����·��ӣ�����acb��