题目内容
【题目】某同学设计如下实验装置探究“分子的性质实验”
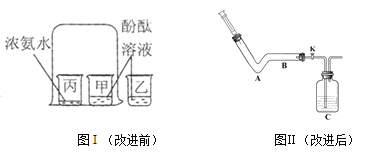
图I是按课本进行的一个化学实验,乙烧杯放有酚酞溶液的目的是______________,此实验说明分子______________________。
但是在实验时同学们闻到了一股难闻的刺激性气味,于是小明对原实验装置进行了改进:装置如图Ⅱ,并进行如下操作:
B处放置滴有酚酞溶液的滤纸,用注射器注入少量浓氨水。一段时间后,观察到B处的现象是__________________________________________
对比改进前的实验,改进后实验的优点是___________________________。
【答案】对比,说明空气中的成分不能使酚酞溶液变色 说明分子在不断运动 滤纸上被滴有酚酞的位置变红 装置密闭性更好,避免了氨气逸散到空气中,更为环保
【解析】
根据分子是不断运动的结合对比试验分析解答。解:浓氨水具有挥发性,挥发性氨气遇到的酚酞试液变红。图I是按课本进行的一个化学实验,乙烧杯放有酚酞溶液的目的是:对比,说明空气中的成分不能使酚酞溶液变色;甲烧杯中溶液由无色逐渐变红,丙烧杯内无明显变化,此实验说明分子在不断运动;B处放置滴有酚酞溶液的滤纸,用注射器注入少量浓氨水。由于氨分子是不断运动的,一段时间后,观察到B处的现象是:滤纸上被滴有酚酞的位置变红,对比改进前的实验,改进后实验的优点是:装置密闭性更好,避免了氨气逸散到空气中,更为环保。

【题目】合成氨是人类科学技术上的一项重大突破,对社会发展与科技进步做出了巨大贡献。合成氨工艺的主要流程如下:
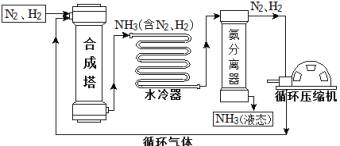
(1)合成塔中的反应必须在高温、高压、催化剂条件下进行,该反应的化学方程式是:_______,属于________(填基本反应类型)反应。
(2)生产过程中从合成塔中输出的气体属于______(填“纯净物”或“混合物”)。
(3)生产过程中可重复循环使用的物质是________。
(4)根据表中的数据回答问题。
物质 | H2 | N2 | O2 | NH3 |
沸点/℃(1.01×105 Pa) | –252 | –195.8 | –183 | –33.35 |
在1.01×105 Pa时,欲将NH3与N2、H2分离,最好将温度控制在________℃ 之间。
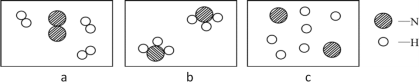
(5)1909年,化学家哈伯用氮气和氢气在高温高压条件下首次合成了氨气,反应原理是N2+3H2 ![]() 2NH3。若用下面三幅模型图表示合成氨气的过程,则从反应开始到完成的排列顺序为_______(用字母表示)。
2NH3。若用下面三幅模型图表示合成氨气的过程,则从反应开始到完成的排列顺序为_______(用字母表示)。
【题目】某小组将光亮铜片放在酒精灯火焰上加热,发现表面变黑,他们对黑色物质来源展开探究。
(猜想假设)猜想1:黑色固体是酒精燃烧生成。
猜想2:黑色固体是铜与空气反应生成。
(查阅资料)
(1)酒精等含碳物质在氧气不充足时会燃烧生成炭黑,炭黑难溶于水,与稀硫酸不反应。
(2)氧化铜加热时能溶于稀硫酸生成蓝色溶液
(进行实验)
实验步骤和方法 | 实验现象 | 实验结论 |
实验一:取一小段光亮铜片,放入试管内,然后用试管夹夹持试管,放在酒精灯的外焰部位加热。 | 铜片表面_______(“变”或“不变”)黑。 | 猜想1不正确 |
实验二:另取一小段光亮铜片用金属铝严密包裹,压紧不留空隙,放在酒精灯的外焰部位加热一段时间后,打开包裹的铝箔,观察现象。 | 刚打开包裹的铝箔时铜片不变黑;一段时间后铜片变黑。 | 猜想2正确 |
实验三:再取一小段光亮铜片,在酒精灯火焰上加热变黑。然后把附着黑色固体的铜片投入到有稀硫酸的试管中,加热。 | 盛黑色固体全部溶解消失,溶液____。 | 猜想2正确 |
(反思拓展)
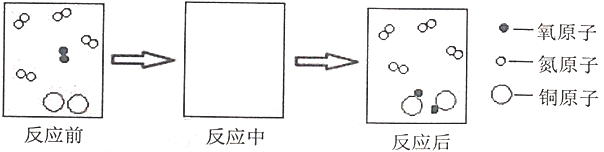
(1)请用符号表达式表示黑色物质的来源:_______;反应过程的微观示意图可简单表示如下,请在反应中方框内画出正确的图示。_______
(2)实验二用金属铝箔将铜片严密包裏的目的是_______;
(3)实验方案的设计主要有从反应物和从生成物两个角度。上述实验主要从反应物角度设计的是______(填序号)
a.实验一 b.实验二 c.实验三
【题目】某校研究性学习小组在做“寻找新的催化剂”课题时,发现将生锈的铁钉放到过氧化氢溶液中,也可以加快过氧化氢的分解速率。于是,他们对此展开探究:
(提出问题)生锈的铁钉中,哪种物质能做H2O2分解的催化剂?与二氧化锰相比哪种物质更适合H2O2做分解的催化剂?
(提出猜想)猜想一:林菲同学:铁钉表面的氧化铁是过氧化氢溶液分解反应的催化剂。
猜想二:小华同学:铁钉中的铁是H202分解的催化剂。
实验编号 | 操作步骤 | 实验现象 |
实验1 | 将带火星的木条伸入盛有10mL 5%的H2O2溶液的试管内,观察现象 | 木条不复燃 |
实验2 | 在盛有1克氧化铁固体的试管中加入10mL5%的H2O2溶液,再将带火星的木条伸入试管内,观察现象. | 有大量气泡产生,带火星的木条复燃 |
实验3 | 在盛有1克铁粉的试管中加入10mL 5%的H2O2溶液,再将带火星的木条伸入试管内,观察现象. | 木条不复燃 |
(分析与结论)
(1)设计“实验1”的作用是_________;
(2)由上述实验可知,猜想___错误。实验(2)反应的文字表达式为______;
(3)同学们讨论后认为,林菲同学的“实验2”还不能够确切的证明氧化铁就是过氧化氢分解制取氧气的催化剂,理由是:___________。
(4)小华通过仔细观察发现“实验3”中一直没有变化的试管,过了一段时间后试管中也出现了气体,小华觉得很奇怪,你能猜想其中的原因吗?______
(5)请设计实验探究氧化铁和二氧化锰,哪种物质更适合做H2O2分解的催化剂?___________。