题目内容
【题目】根据下图回答问题。
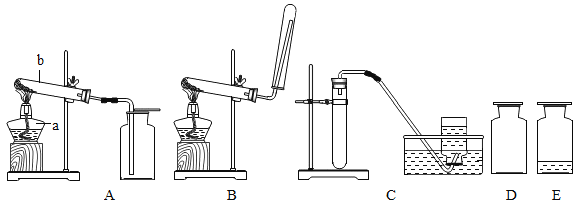
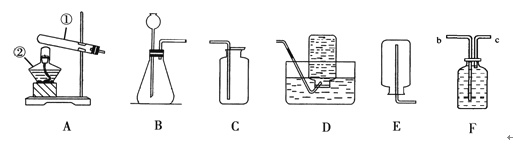
A B C D E
(1)写出标有序号仪器的名称:a ,b 。
(2)实验室用高锰酸钾制取氧气应选用的装置是 (填装置下方的字母序号),该化学反应的文字表达式为 ,检验氧气是否收集满的方法是 。
(3)若用C装置制取氧气,则试管中应盛放的药品是 。
(4)图中D、E是收集到的两瓶氧气,若进行铁丝在氧气中燃烧的实验,应选用的一瓶是 (填装置下方的字母序号)。实验中可观察到铁丝剧烈燃烧, 。
【答案】(1)酒精灯 试管(2)A 高锰酸钾![]() 锰酸钾+二氧化锰+氧气 将带火星的木条接近集气瓶口,若木条复燃,则说明氧气已满;否则,则说明氧气未满。(3)过氧化氢溶液、二氧化锰(其他合理答案均可得分)(4)E 火星四射,产生黑色固体,放出热量
锰酸钾+二氧化锰+氧气 将带火星的木条接近集气瓶口,若木条复燃,则说明氧气已满;否则,则说明氧气未满。(3)过氧化氢溶液、二氧化锰(其他合理答案均可得分)(4)E 火星四射,产生黑色固体,放出热量
【解析】
试题分析:(1)序号仪器的名称依次为酒精灯、试管;(2)实验室用高锰酸钾制取氧气应选用固体加热型装置A,反应的文字表达式为高锰酸钾![]() 锰酸钾+二氧化锰+氧气,检验氧气是否收集满的方法是将带火星的木条接近集气瓶口,若木条复燃,则说明氧气已满;否则,则说明氧气未满。(3)若用C装置制取氧气,则试管中应盛放的药品是过氧化氢溶液和二氧化锰;(4)图中D、E是收集到的两瓶氧气,若进行铁丝在氧气中燃烧的实验,应选用下部留有少量水的集气瓶。实验中可观察到铁丝剧烈燃烧火星四射,产生黑色固体,放出热量
锰酸钾+二氧化锰+氧气,检验氧气是否收集满的方法是将带火星的木条接近集气瓶口,若木条复燃,则说明氧气已满;否则,则说明氧气未满。(3)若用C装置制取氧气,则试管中应盛放的药品是过氧化氢溶液和二氧化锰;(4)图中D、E是收集到的两瓶氧气,若进行铁丝在氧气中燃烧的实验,应选用下部留有少量水的集气瓶。实验中可观察到铁丝剧烈燃烧火星四射,产生黑色固体,放出热量

【题目】合成氨是人类科学技术上的一项重大突破,对社会发展与科技进步做出了巨大贡献。合成氨工艺的主要流程如下:
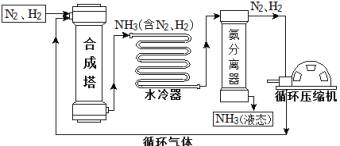
(1)合成塔中的反应必须在高温、高压、催化剂条件下进行,该反应的化学方程式是:_______,属于________(填基本反应类型)反应。
(2)生产过程中从合成塔中输出的气体属于______(填“纯净物”或“混合物”)。
(3)生产过程中可重复循环使用的物质是________。
(4)根据表中的数据回答问题。
物质 | H2 | N2 | O2 | NH3 |
沸点/℃(1.01×105 Pa) | –252 | –195.8 | –183 | –33.35 |
在1.01×105 Pa时,欲将NH3与N2、H2分离,最好将温度控制在________℃ 之间。
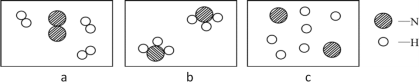
(5)1909年,化学家哈伯用氮气和氢气在高温高压条件下首次合成了氨气,反应原理是N2+3H2 ![]() 2NH3。若用下面三幅模型图表示合成氨气的过程,则从反应开始到完成的排列顺序为_______(用字母表示)。
2NH3。若用下面三幅模型图表示合成氨气的过程,则从反应开始到完成的排列顺序为_______(用字母表示)。
【题目】人教版新课标化学教材九年级上册“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂研究性实验,引起了化学探究小组的兴趣。
(提出问题)氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
(实验探究)
实验步骤 | 实验现象 |
I.分别量取5mL5%过氧化氢溶液放入A、B两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象。 |
II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木条均复燃 |
III.将实验II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag。 |
|
IV.分别量取5mL5%过氧化氢溶液放入C、D两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入__________g二氧化锰粉末,观察现象。 | D试管中产生气泡的速率比C试管快 |
(实验结论)
(1)A中产生的气体是_________________;
(2)实验Ⅱ、Ⅲ证明:氧化铁的________________和______________在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)写出氧化铁催化过氧化氢分解的文字或者符号表达式__________________________。
(实验评价)
(4)实验设计IV的目的是_____________________________________________________;此步骤中二氧化锰的质量应该是_______________g
(5)通过实验IV,你可以得到的结论是_________________________________________。