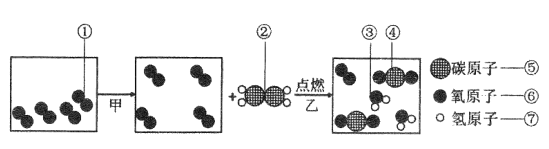
题目内容
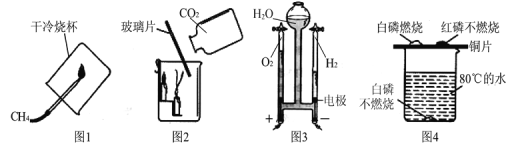
【题目】实验室制取气体时所需的一些装置如下图所示。据图回答下列问题:

(1)写出指定仪器的名称: ①__________;②__________。
(2)小明同学想以氯酸钾和二氧化锰为原料制取一瓶干燥的氧气,他选择了C装置,你帮他选择的收集装置是______(填装置标号,下同),写出该方法制氧气的符号表达式________________。
(3)小华同学要以高锰酸钾为原料制取氧气,她也选用了C装置,她需要对该装置进行改进的地方是______________,有关反应的符号表达式 ______________________。
(4)做“铁丝在氧气里燃烧”实验时,为了防止集气瓶底炸裂,实验前常采取的措施是______,写出该实验变化的符号表达式为________________________。
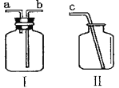
(5)实验室在常温下用块状电石(主要成分CaC2)与水反应制取不易溶于水的乙炔(C2H2)气体,该反应必须严格控制加水速度,以免剧烈反应放热引起发生装置炸裂。你认为最适合制取乙炔气体的发生装置是__________。
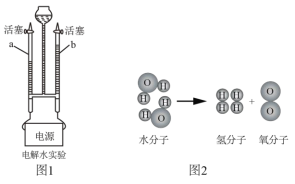
(6)常温下NO是一种无色、难溶于水的气体,密度比空气略大,在空气中能与氧气迅速反应生成红棕色的NO2气体(2NO+O2==2NO2)。为了收集纯净的NO 气体,利用如图所示仪器Ⅰ、Ⅱ,用胶管将_____ (填导管口字母)与c相连组成收集装置.收集时,应先在Ⅰ中____________________。
【答案】集气瓶 铁架台 E KClO3![]() KCl+O2 在试管口加一团棉花 KMnO4
KCl+O2 在试管口加一团棉花 KMnO4 ![]() K2MnO4+MnO2+O2 在集气瓶中加少量的水或沙 Fe + O2
K2MnO4+MnO2+O2 在集气瓶中加少量的水或沙 Fe + O2 ![]() Fe3O4 A b 装满水
Fe3O4 A b 装满水
【解析】
(1)根据常见仪器的名称解答;
(2)用氯酸钾制氧气的原理,氧气的性质进行分析解答;
(3)用高锰酸钾制氧气的原理、实验注意事项进行解答;
(4)根据铁在氧气燃烧实验原理、实验注意事项进行解答;
(5)根据反应物状态和反应条件选择装置,根据装置的特点选择最适合的装置;
(6)根据NO的性质选择收集装置。
(1)仪器①的名称是集气瓶;仪器②的名称是铁架台;
(2)排空气法收集得到氧气比用排水法收集得到的氧气干燥,氧气的密度大于空气,可用向上排空气法收集,收集装置是E,氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,反应符号表达式是KClO3![]() KCl+O2;
KCl+O2;
(3)以高锰酸钾为原料制取氧气,她也选用了C装置,为了防止高锰酸钾粉末进入导管,她需要对该装置进行改进的地方是在试管口加一团棉花,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,反应的符号表达式是KMnO4 ![]() K2MnO4+MnO2+O2;
K2MnO4+MnO2+O2;
(4)做铁丝在氧气中燃烧实验前,集气瓶底要放少量水或细沙,防止高温生成物溅落瓶底,使集气瓶底炸裂;铁与氧气在点燃的条件下反应生成四氧化三铁,反应的符号表达式是Fe + O2 ![]() Fe3O4;
Fe3O4;
(5)根据“实验室在常温下用块状电石(主要成分CaC2)与水反应制取不易溶于水的乙炔(C2H2)气体”可知,反应物的状态是固体与液体,不需加热,可选择的发生装置是A或B,该反应必须严格控制加水速度,以免剧烈反应放热引起发生装置炸裂。注射器能控制液体的滴加速度,能控制反应的速度,最适合制取乙炔气体的发生装置是A;
(6)由于NO是一种难溶于水的气体,可以用排水法收集,密度比空气略大,在空气中能与氧气迅速反应生成红棕色的NO2气体,所以不能用排空气法收集,所以应先在Ⅰ中装满水,NO密度小于水,用排水法收集气体必须从短(a)管进入,所以b端连接c。

 阅读快车系列答案
阅读快车系列答案【题目】合成氨是人类科学技术上的一项重大突破,对社会发展与科技进步做出了巨大贡献。合成氨工艺的主要流程如下:
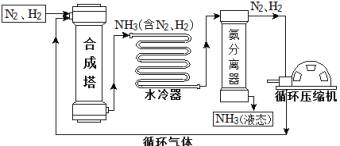
(1)合成塔中的反应必须在高温、高压、催化剂条件下进行,该反应的化学方程式是:_______,属于________(填基本反应类型)反应。
(2)生产过程中从合成塔中输出的气体属于______(填“纯净物”或“混合物”)。
(3)生产过程中可重复循环使用的物质是________。
(4)根据表中的数据回答问题。
物质 | H2 | N2 | O2 | NH3 |
沸点/℃(1.01×105 Pa) | –252 | –195.8 | –183 | –33.35 |
在1.01×105 Pa时,欲将NH3与N2、H2分离,最好将温度控制在________℃ 之间。
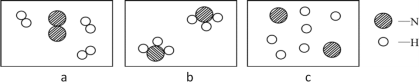
(5)1909年,化学家哈伯用氮气和氢气在高温高压条件下首次合成了氨气,反应原理是N2+3H2 ![]() 2NH3。若用下面三幅模型图表示合成氨气的过程,则从反应开始到完成的排列顺序为_______(用字母表示)。
2NH3。若用下面三幅模型图表示合成氨气的过程,则从反应开始到完成的排列顺序为_______(用字母表示)。