题目内容
(1)甲、乙两种固体物质的溶解度曲线如图1所示.
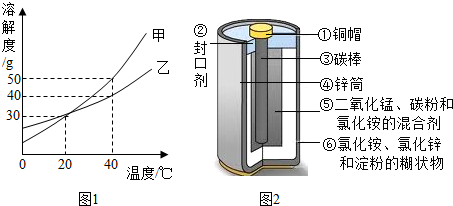
①40℃时20g 甲物质加入到80g水中不断搅拌,形成的溶液中溶质的质量分数是 .
②李青同学要配制甲、乙两种物质的饱和溶液,而且溶质的质量分数相同,他应该将温度控制在 ℃.
③40℃时50g乙物质加到100g水中,充分搅拌后,还有 g固体未溶解,如果要使其溶解,你的方法是 .
(2)目前,废旧电池对环境的污染已越来越引起人们的重视.为了实现可持续发展的战略目标,许多有识之士正在研究废旧电池的有效回收再利用技术.如图2为普通电池(锌锰电池)示意图,请你根据图示分析:
①将回收的废旧电池进行分离,可以得到的单质有(用化学式表示,下同) ,氧化物有 ,盐有 ,有机物有(写名称) .
②小李同学想得到⑤中纯净干燥的二氧化锰和氯化铵溶液,并检验氯化铵中的铵根离子.设计了如下实验步骤,请你帮他完成:

①40℃时20g 甲物质加入到80g水中不断搅拌,形成的溶液中溶质的质量分数是
②李青同学要配制甲、乙两种物质的饱和溶液,而且溶质的质量分数相同,他应该将温度控制在
③40℃时50g乙物质加到100g水中,充分搅拌后,还有
(2)目前,废旧电池对环境的污染已越来越引起人们的重视.为了实现可持续发展的战略目标,许多有识之士正在研究废旧电池的有效回收再利用技术.如图2为普通电池(锌锰电池)示意图,请你根据图示分析:
①将回收的废旧电池进行分离,可以得到的单质有(用化学式表示,下同)
②小李同学想得到⑤中纯净干燥的二氧化锰和氯化铵溶液,并检验氯化铵中的铵根离子.设计了如下实验步骤,请你帮他完成:
| 实验步骤 | 实验现象 | 结论或解释 |
| ①剥开干电池,取出碳棒周围的黑色粉末. | / | / |
| ②溶解、 | 得到黑色粉末和无色澄清液体 | 黑色粉末的成份为 |
| ③对黑色粉末进行 | / | 得到纯净的MnO2固体 |
| ④检验第②步中得到的无色澄清液体中是否含铵根离子的方法是: | 化学方程式为: |
考点:固体溶解度曲线及其作用,证明铵盐,饱和溶液和不饱和溶液相互转变的方法,溶质的质量分数、溶解性和溶解度的关系,有关溶质质量分数的简单计算,金属的回收利用及其重要性,从组成上识别氧化物,单质和化合物的判别,常见的氧化物、酸、碱和盐的判别,有机物与无机物的区别,书写化学方程式、文字表达式、电离方程式
专题:溶液、浊液与溶解度,金属与金属材料,物质的检验、鉴别与推断
分析:(1)①据该温度下甲的溶解度分析解答;
②据饱和时质量分数的计算式
×100%可知:溶解度相等则溶质的质量分数相等;
③要使溶质继续溶解,可采取加入溶剂或升温的方法;
(2)①根据物质的分类知识和单质、氧化物、盐、有机物的定义回答.
②碳棒周围的黑色粉末主要有二氧化锰、碳粉和氯化铵,因为氯化铵溶于水,所以可先溶解,再过滤,滤液为氯化铵溶液,滤渣是二氧化锰和碳粉;
根据实验目的要制备纯净的二氧化锰,所以必须对二氧化锰中的碳粉进行处理;
根据氯化铵溶液与碱反应可以生成氨气进行检验.
②据饱和时质量分数的计算式
| 溶解度 |
| 溶解度+100g |
③要使溶质继续溶解,可采取加入溶剂或升温的方法;
(2)①根据物质的分类知识和单质、氧化物、盐、有机物的定义回答.
②碳棒周围的黑色粉末主要有二氧化锰、碳粉和氯化铵,因为氯化铵溶于水,所以可先溶解,再过滤,滤液为氯化铵溶液,滤渣是二氧化锰和碳粉;
根据实验目的要制备纯净的二氧化锰,所以必须对二氧化锰中的碳粉进行处理;
根据氯化铵溶液与碱反应可以生成氨气进行检验.
解答:解:(1)①40℃时甲的溶解度是50g,即100g水中最多溶解50g的甲,则20g 甲物质加入到80g水中不断搅拌可充分溶解,形成的溶液中溶质的质量分数是
×100%=20%;
②据饱和时质量分数的计算式
×100%可知:溶解度相等则溶质的质量分数相等;所以李青同学要配制甲、乙两种物质的饱和溶液,则该温度下二者的溶解度应该相等,观察图示可知:20℃时二者的溶解度相等,可配制该温度下溶质的质量分数相同的溶液;
③40℃时乙的溶解度是40g,所以50g乙物质加到100g水中,充分搅拌后,还有10g不能溶解,乙的溶解度随温度升高而增大,故要使溶质继续溶解,可采取加入溶剂或升温的方法;
(2)①单质是由同种元素组成的纯净物,碳、锌、铜等符合定义;氧化物是由两种元素组成的,且其中一种元素为氧元素的化合物,二氧化锰符合定义;盐是指由金属离子(或铵根离子)与酸根离子构成的化合物,氯化锌、氯化铵符合定义;有机物是大部分由C、H、O组成,淀粉符合定义;
②碳棒周围的黑色粉末主要有二氧化锰、碳粉和氯化铵,因为氯化铵溶于水,所以可先溶解,再过滤,滤液为氯化铵溶液,滤渣是二氧化锰和碳粉根据实验目的是要达到纯净干燥的二氧化锰,所以对滤渣进行灼烧,可以将碳粉变为二氧化碳除去,表面残留的氯化铵受热分解也除去了;根据氯化铵溶液与碱反应可以生成氨气,NH4Cl+NaOH═NaCl+H2O+NH3↑,氨气呈碱性且有刺激性气味,所以可以设计实验为取少量滤液于试管中,加入氢氧化钠溶液,然后检验生成的气体即可;
故答案为:(1)①20%; ②20; ③10; 升高温度(或加入溶剂);
(2)①Cu、C、Zn; MnO2; NH4Cl、ZnCl2; 淀粉;
②
| 20g |
| 20g+80g |
②据饱和时质量分数的计算式
| 溶解度 |
| 溶解度+100g |
③40℃时乙的溶解度是40g,所以50g乙物质加到100g水中,充分搅拌后,还有10g不能溶解,乙的溶解度随温度升高而增大,故要使溶质继续溶解,可采取加入溶剂或升温的方法;
(2)①单质是由同种元素组成的纯净物,碳、锌、铜等符合定义;氧化物是由两种元素组成的,且其中一种元素为氧元素的化合物,二氧化锰符合定义;盐是指由金属离子(或铵根离子)与酸根离子构成的化合物,氯化锌、氯化铵符合定义;有机物是大部分由C、H、O组成,淀粉符合定义;
②碳棒周围的黑色粉末主要有二氧化锰、碳粉和氯化铵,因为氯化铵溶于水,所以可先溶解,再过滤,滤液为氯化铵溶液,滤渣是二氧化锰和碳粉根据实验目的是要达到纯净干燥的二氧化锰,所以对滤渣进行灼烧,可以将碳粉变为二氧化碳除去,表面残留的氯化铵受热分解也除去了;根据氯化铵溶液与碱反应可以生成氨气,NH4Cl+NaOH═NaCl+H2O+NH3↑,氨气呈碱性且有刺激性气味,所以可以设计实验为取少量滤液于试管中,加入氢氧化钠溶液,然后检验生成的气体即可;
故答案为:(1)①20%; ②20; ③10; 升高温度(或加入溶剂);
(2)①Cu、C、Zn; MnO2; NH4Cl、ZnCl2; 淀粉;
②
| 实验步骤 | 实验现象 | 结论或解释 |
| ①剥开干电池,取出碳棒周围的黑色粉末. | / | / |
| ②溶解、过滤、洗涤(填操作名称). | 得到黑色粉末和无色澄清液体 | 黑色粉末的成份为 二氧化锰和炭粉. |
| ③对黑色粉末进行 灼烧(或暴露在空气中加强热). | / | 得到纯净的MnO2固体 |
| ④检验第②步中得到的无色澄清液体中是否含铵根离子的方法是:取样于试管中,加入氢氧化钠溶液并加热(把湿润的红色石蕊试纸放在试管口). | 强烈刺激性气味(或湿润的红色石蕊试纸变蓝色) | 化学方程式为: NH4Cl+NaOH═NaCl+H2O+NH3↑ |
点评:本题考查了溶解度曲线的相关知识,并以生活中的干电池为依托,对物质的分类及物质的除杂、分离等重要知识进行了考查,考查了学生运用化学知识解决具体问题的能力.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
下列实验现象描述不正确的是( )
| A、白磷燃烧产生大量的白烟 |
| B、硫在空气中燃烧,产生淡蓝色火焰 |
| C、镁带在空气中剧烈燃烧,产生耀眼白眼白光,生成白色固体 |
| D、电解水时正极产生的气体比负极产生的气体多 |
下列鉴别物质的方法中,切实可行的是( )
| A、用酚酞溶液鉴别NaCl溶液和盐酸 |
| B、用燃着的木条鉴别CO2和N2 |
| C、用石蕊溶液鉴别稀盐酸和稀硫酸 |
| D、用碳酸钠溶液鉴别澄清石灰水、氢氧化钠溶液、稀盐酸三种无色溶液 |