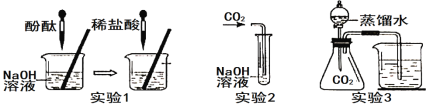
题目内容
【题目】化学实验室常常产生许多废液,经无害化处理后可防止对环境的破坏。化学兴趣小组同学设计了四组实验对NaOH溶液和Ca(OH)2溶液进行鉴别,请你参与实验,并对废液的成分展开探究。
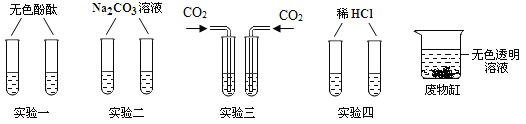
(1)上述四组实验不能达到鉴别目的的是_____。
(2)实验中产生白色沉淀H属于复分解反应的化学方程式_____。
(3)将上述四组实验的八支试管中的废液倒入一个洁净的大烧杯中 ,先有大量的气泡,后沉淀消失,得到澄清无色透明溶液。那么,该废液中含有哪些物质呢(酚酞除外) ?
(查阅资料) NaCl、 CaCl2溶液呈中性
(猜想)A: NaCl、CaCl2、NaOH B: NaCl、 CaCl2 C:______。
大家经认真思考后,认为猜想______一定是错的。理由是______。
(设计实验)
实验方案 | 实验操作 | 实验现象 | 实验结论 |
方案一 | 取废物缸中少量试液于试管,滴入含有稀HNO3的AgNO3溶液 | _____。 | 猜想C正确 |
方案二 | 另取废物缸中少量试液于另一试管中,加入少量_______固体。 | 固体溶解消失, 溶液变成蓝色 |
(反思)大家交流后,认为实验方案一 有问题,你认为原因是_____。
另外,大家共同决定在废液中加入适量的碳酸钠溶液,恰好完全反应后,过滤。再将废液进行______(填实验操作),就可以将废液处理并回收得到NaCl。
【答案】实验一和实验四 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH NaCl、CaCl2、HCl A 反应后澄清无色透明溶液,说明反应后溶液呈中性或酸性,氢氧化钠呈碱性,所以反应后溶液中溶质一定不存在氢氧化钠 产生白色沉淀 氢氧化铜或氧化铜 氯化钙和盐酸都能与硝酸银产生白色沉淀 过滤
【解析】
(1)实验一:NaOH溶液和Ca(OH)2溶液都呈碱性,加入酚酞后溶液都呈红色,现象相同,不能鉴别;
实验二:碳酸钠溶液与氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,氢氧化钠与碳酸钠溶液不能反应,加入碳酸钠溶液后产生白色沉淀的是氢氧化钙,无明显变化的是氢氧化钠溶液,现象不同,可以鉴别;
实验三:二氧化碳与氢氧化钠溶液能反应,没有明显的实验现象,二氧化碳能使澄清石灰水变浑浊,现象不同,可以鉴别;
实验四:NaOH溶液和Ca(OH)2溶液都以能与盐酸反应,但没有明显的现象,现象相同,不能鉴别。四组实验不能达到鉴别目的的是实验一和实验四;
(2)实验中产生白色沉淀H的反应是二氧化碳与氢氧化钙反应生成碳酸钙和水,碳酸钠溶液与氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,其中二氧化碳与氢氧化钙反应由于没有相互交换成分,不属于复分解反应,碳酸钠溶液与氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,该反应是由两种化合物互相交换成分,生成另外两种化合物的反应属于复分解反应,反应的化学化学方程式是:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(3)猜想:
将上述四组实验的八支试管中的废液倒入一个洁净的大烧杯中 ,先有大量的气泡,后沉淀消失,得到澄清无色透明溶液,说明废液中存在盐酸,反应后溶液呈中性或酸性,盐酸可能有剩余,反应过程中钠离子、钙离子、氯离子没有形成沉淀、气体,在溶液一定存在,所以猜想C可能是NaCl、CaCl2、HCl;猜想A一定是错的。理由是反应后澄清无色透明溶液,说明反应后溶液呈中性或酸性,氢氧化钠呈碱性,所以反应后溶液中溶质一定不存在氢氧化钠;
设计实验:
盐酸与硝酸银反应生成氯化银沉淀和硝酸钠,氯化钙与硝酸银反应生成氯化银和硝酸钠,氢氧化铜与盐酸反应生成蓝色氯化铜溶液和水,氧化铜与盐酸反应生成蓝色氯化铜溶液和水。因此:
实验方案 | 实验操作 | 实验现象 | 实验结论 |
方案一 | 取废物缸中少量试液于试管,滴入含有稀HNO3的AgNO3溶液 | 产生白色沉淀 | 猜想C正确 |
方案二 | 另取废物缸中少量试液于另一试管中,加入少量氢氧化铜或氧化铜固体。 | 固体溶解消失, 溶液变成蓝色 |
反思:实验方案一有问题,原因是氯化钙和盐酸都能与硝酸银产生白色沉淀;
碳酸钠溶液与氯化钙溶液反应生成碳酸钙沉淀和氯化钠,碳酸钠溶液与盐酸反应生成氯化钠、水和二氧化碳。大家共同决定在废液中加入适量的碳酸钠溶液,恰好完全反应后,过滤。再将废液进行过滤,就可以将废液处理并回收得到NaCl。