题目内容
【题目】⑴用化学符号表示:2个氮原子_____,1 个二氧化硫分子_____
⑵下列原子结构示意图中,表示金属原子的是____(填序号)。
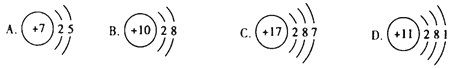
【答案】![]()
![]() D
D
【解析】
原子的表示方法:用元素符号来表示一个原子,表示几个,就在元素符号前面写上数字;分子表示方法:在物质的化学式前面写上数字即可;从原子结构来看,金属元素的原子最外层电子数一般少于4,非金属元素的原子最外层电子数一般大于4。
⑴ 原子的表示方法:用元素符号来表示一个原子,表示几个,就在元素符号前面写上数字2个氮原子,2个氮原子可表示为![]() ;分子表示方法:在物质的化学式前面写上数字即可,1 个二氧化硫分子可表示为
;分子表示方法:在物质的化学式前面写上数字即可,1 个二氧化硫分子可表示为![]() 。
。
⑵ 从原子结构来看,金属元素的原子最外层电子数一般少于4,非金属元素的原子最外层电子数一般大于4,故表示金属原子的是D。

【题目】化学实验室常常产生许多废液,经无害化处理后可防止对环境的破坏。化学兴趣小组同学设计了四组实验对NaOH溶液和Ca(OH)2溶液进行鉴别,请你参与实验,并对废液的成分展开探究。
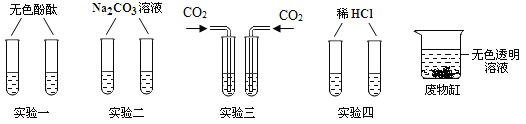
(1)上述四组实验不能达到鉴别目的的是_____。
(2)实验中产生白色沉淀H属于复分解反应的化学方程式_____。
(3)将上述四组实验的八支试管中的废液倒入一个洁净的大烧杯中 ,先有大量的气泡,后沉淀消失,得到澄清无色透明溶液。那么,该废液中含有哪些物质呢(酚酞除外) ?
(查阅资料) NaCl、 CaCl2溶液呈中性
(猜想)A: NaCl、CaCl2、NaOH B: NaCl、 CaCl2 C:______。
大家经认真思考后,认为猜想______一定是错的。理由是______。
(设计实验)
实验方案 | 实验操作 | 实验现象 | 实验结论 |
方案一 | 取废物缸中少量试液于试管,滴入含有稀HNO3的AgNO3溶液 | _____。 | 猜想C正确 |
方案二 | 另取废物缸中少量试液于另一试管中,加入少量_______固体。 | 固体溶解消失, 溶液变成蓝色 |
(反思)大家交流后,认为实验方案一 有问题,你认为原因是_____。
另外,大家共同决定在废液中加入适量的碳酸钠溶液,恰好完全反应后,过滤。再将废液进行______(填实验操作),就可以将废液处理并回收得到NaCl。
【题目】结合下图回答下列问题:
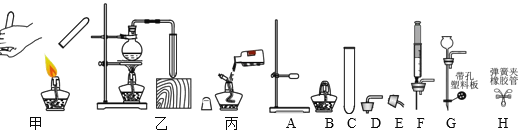
(1)仪器C的名称是______;
(2)甲、乙、丙三个操作正确的是____ ;选择其中一个错误的操作进行改正:____。
(3)气体的制取是重要实验技能。
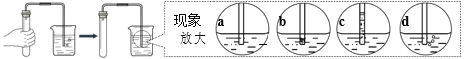
①某同学选择C、D组成发生装置制取氢气,并采用下图所示方法检査装置的气密性, 若装置的气密性良好,则松手一段时间后,烧杯内导管处的现象(画圈部分)是_____(填现象代号)。
②实验室用加热高锰酸钾制取氧气,应选择_______组成发生装置(填代号,下同);反应方程式为______。为了研究用向上排空气法和排水法收 集的氧气浓度是否有差异,某化学学习小组做了如下实验:加热高锰酸钾固体,分别用两种方法各收集三瓶氧气,并使用传感器测定收集到的氧气浓度,数据见下表。
收集方法 | 向上排空气法 | 排水法 | ||||
O2浓度/% | 79.6 | 79.7 | 79.8 | 90.0 | 89.8 | 89.3 |
O2平均浓度/% | 79.7 | 89.7 | ||||
Ⅰ:用排水法收集氧气时,以观察到____为氧气集满的标准;
Ⅱ:向上排空气法收集到的氧气浓度只有 80%左右,下列说法错误的是_____。
A 加热高锰酸钾固体产生氧气的浓度只有 80%左右
B 氧气的密度略大于空气的密度,无法将空气排尽
C 当观察到带火星木条伸到瓶口验满,木条复燃时,集气瓶内还有剩余空气
③实验室用电石(主要成分为 CaC2)和饱和 NaCl 溶液制取乙炔(C2H2)可燃性气体, 该反应猛烈,为了获得平稳气流,应选_____组成发生装置。用操作甲检验
乙炔的纯度时,产生尖锐爆鸣声,说明收集气体__________。
(4)下图为某化学小组的同学设计的研究氢氧化钠性质的趣味实验(实验前止水夹 K1、K2、K3 均关闭)。
实验过程:
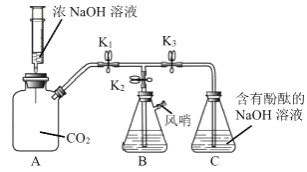
a向下推注射器,将氢氧化钠浓溶液注入瓶中。
b 打开K1和K3,C中部分 液体流入A。
c关闭K1,打开K2,风哨鸣叫,B中部分液体流入C。
①实验过程b中C中部分液体倒吸入A的原因是____(用化学方程式表示)。
②若A中溶液的溶质换成Ba(OH)2,则注液时产生现象是____。
【题目】重庆一中化学兴趣小组的同学将氢氧化钠溶液和稀硫酸混合,没有观察到明显的现象,他们对此提出了如下问题并进行了相应探究:
问题一:二者之间是否发生了反应?他们设计了如下方案证明二者之间确实发生了反应:
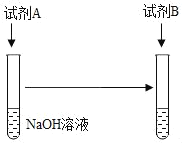
(1)可以选择的试剂组合有_____(填序号)。
①试剂 A:足量稀硫酸,试剂 B:MgCl2溶液
②试剂 A:足量稀硫酸,试剂 B:铁粉
③试剂 A:少量稀硫酸,试剂 B:MgCl2溶液
④试剂 A:少量稀硫酸,试剂 B:铁粉
(2)小兰认为,若选用_____溶液,不管加入顺序如何,只需控制加入稀硫酸的量也 能证明二者发生了反应。
问题二:反应后溶液中溶质有哪些?
(猜想假设)猜想一:只有 Na2SO4;猜想二:Na2SO4 和_____;猜想三:Na2SO4 和 H2SO4。
(查阅资料)①Na2SO4 溶液显中性,②Na2SO4+BaCl2=BaSO4↓+2NaCl。
(实验操作)分别取少量反应后的溶液于试管中,进行如下实验:
实验编号 | 实验过程 | 实验现象 |
① | 加入酚酞溶液 | 不变红 |
② | 加入少量 BaCl2溶液 | 产生白色沉淀 |
③ | 加入少量 Na2CO3溶液 | _____(填“有”或“无”)气泡产生 |
(实验结论)猜想一成立。
(实验反思)小娜认为,实验_____(填实验编号)可省略。 小秋用精密仪器检测反应后溶液中离子的个数比,也得出了相同结论,则测得溶液中的 Na+和 SO42﹣个数比为_____。