题目内容
【题目】根据下列实验回答问题。
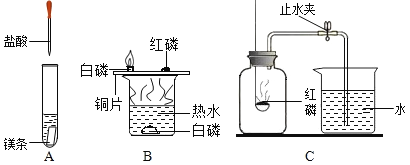
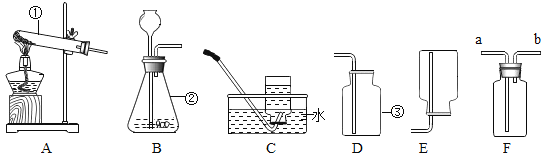
(1)A实验中的现象是__________。
(2)B实验中水的作用是_________。白磷燃烧的化学方程式为_______。
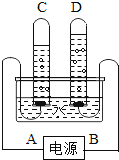
(3)某同学用C装置(气密性良好)测定空气中氧气含量时,因红磷量不足,其结果明显小于1/5,接着他将装置中水倒出,马上又用此装置进行了第二次实验(红磷过量,气密性良好),发现结果还是明显小于1/5,其原因是________。
【答案】镁条逐渐溶解,并且有大量气泡冒出,反应放热 隔绝氧气和提供温度 ![]() 未待装置冷却至室温就打开止水夹
未待装置冷却至室温就打开止水夹
【解析】
(1)活泼金属与酸反应可放出氢气,因此往镁条中滴入稀盐酸,观察到的现象是镁条逐渐溶解,并且有大量气泡冒出,反应放热。
(2)在热水中和铜片上均有反应物,此实验主要来探究燃烧所需要的条件,在热水中的红磷因为没有助燃氧气,无法燃烧;因白磷着火点远低于红磷,因此铜片吸热,达到白磷着火点即可燃烧,但未达到红磷着火点,红磷不会被引燃,因此热水的目的是隔绝氧气和提供温度。白磷燃烧的化学方程式为:![]() 。
。
(3)在用红磷测量空气中氧气含量实验时,使得结果偏大的原因为:止水夹未加紧、红磷伸入集气瓶较慢;结果偏小的原因为:装置气密性较差、红磷量不足或未待装置冷却至室温就打开止水夹,则答案为:未待装置冷却至室温就打开止水夹。

 阅读快车系列答案
阅读快车系列答案【题目】下列叙述及对应的化学方程式、所属基本反应类型都正确的是( )
A | 洗去试管壁上附着的铜 | Cu+H2SO4=CuSO4+H2↑ | 置换反应 |
B | 酸雨的形成 | CO2 + H2O = H2CO3 | 化合反应 |
C | 用铁桶盛放稀盐酸 | Fe +2HCl=FeCl2+H2 ↑ | 置换反应 |
D | 拉瓦锡探究质量守恒定律 | 2HgO | 分解反应 |
A. AB. BC. CD. D
【题目】蜡烛(主要含 C,H,O 元素)在密闭容器中熄灭的原因是什么?燃烧的产物是什么?亮亮同学认为蜡烛熄灭的原因是燃烧消耗完了容器内的氧气,并对燃烧产物提出猜想:①燃烧的产物可能有CO2;②燃烧的产物可能有 H2O;除了上述猜想,你的猜想:燃烧的产物还可能有________________或_________________(填一种单质和化合物)
实验一:在密闭容器中点燃蜡烛至熄灭,抽取 10mL 密闭容器中的气体,注入到试管中的饱和澄清石灰水中,发现石灰水始终没有变浑浊.从实验的科学性考虑,下一步是____________(选填字母)
A直接得到燃烧产物中没有 CO2 的结论
B增加饱和澄清石灰水的质量
C再多抽取一些气体注入到试管中的石灰水中
实验二:在老师的指导下,利用多功能传感器进行有关量的测量传装置如图所示.实验结束后,铝板表面有黑色固体颗粒,同时传感器采得实验前后的有关数据如表所示:
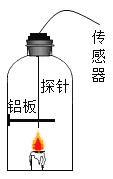
相对湿度 | 氧气含量 | 二氧化碳含量 | 一氧化碳含量 | |
蜡烛点燃前 | 48.4% | 18.7% | 0.058% | 0 |
蜡烛熄灭后 | 71.6% | 15.6% | 36.43% | 0.0182% |
由实验及结果分析,密闭容器内蜡烛熄灭的原因是_____________________,.蜡烛燃烧生成的产物是__________________________(填化学式)。