题目内容
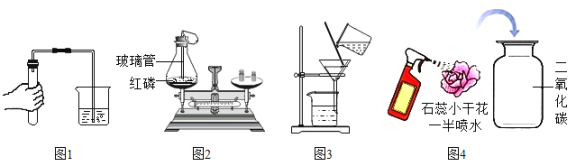
【题目】某同学进行如图实验,充分反应后,将试管①②内的物质倒入同一烧杯中混合再充分反应后过滤,结果得到滤渣A和无色滤液B。
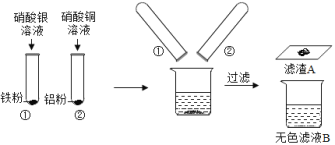
(1)试管①中反应的化学方程式为:_____;试管②中观察到的现象是:有红色固体出现,溶液_____。
(2)过滤操作中需要的玻璃仪器有:烧杯、玻璃棒和_____;无色滤液B中含有的物质是H2O和_____ (填化学式 )。
(3)设计实验探究滤渣A的成分
(提出问题)滤渣A的成分是什么?
(查阅资料)银、铜、铁、铝四种金属中,只有铝可以和氢氧化钠溶液反应,化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑。
(作出猜想)滤渣A的成分为:
猜想Ⅰ:银、铜;猜想Ⅱ:银、铜、铁;猜想Ⅲ:_____。
(分析思考)猜想Ⅰ一定不正确,原因是_____。
(进行实验)取两份滤渣样品进行实验,请填写下列空白:
样品 | 加入试剂 | 现象 |
第一份样品 | 足量稀盐酸 | 产生气泡,固体部分溶解,溶液变_____色 |
第二份样品 | 足量氢氧化钠溶液 | 现象b |
(作出判断)如果现象为b为“产生气泡,固体部分溶解”,则猜想_____成立;
如果现象b为_____,则猜想_____成立。
【答案】Fe+2AgNO3![]() Fe(NO3)2+2Ag 由蓝色变成无色 漏斗 Al(NO3)3 银、铜、铁、铝 滤渣A中一定含有铁 浅绿 Ⅲ 不产生气泡,固体不溶解 Ⅱ
Fe(NO3)2+2Ag 由蓝色变成无色 漏斗 Al(NO3)3 银、铜、铁、铝 滤渣A中一定含有铁 浅绿 Ⅲ 不产生气泡,固体不溶解 Ⅱ
【解析】
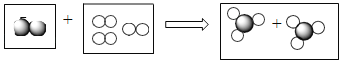
(1)金属活动性顺序中,排在前面的金属能将排在后面的金属从其化合物的水溶液中置换出来,Fe+2AgNO3![]() Fe(NO3)2+2Ag。铝能将硝酸铜溶液中的铜置换出来,2Al+3Cu(NO3)2== 2Al(NO3)3 +3Cu,Cu(NO3)2溶液是蓝色,Al(NO3)3溶液是无色的,所以溶液由蓝色变为无色。
Fe(NO3)2+2Ag。铝能将硝酸铜溶液中的铜置换出来,2Al+3Cu(NO3)2== 2Al(NO3)3 +3Cu,Cu(NO3)2溶液是蓝色,Al(NO3)3溶液是无色的,所以溶液由蓝色变为无色。
(2)过滤操作中需要的玻璃仪器有:烧杯、玻璃棒和漏斗。Fe(NO3)2溶液是浅绿色,所以无色滤液B中含有生成的Al(NO3)3 和溶剂水。
(3)因为铝比铁金属活动性强,无色滤液B中含有Al(NO3)3,无Fe(NO3)2,则是铝将Fe(NO3)2反应完了,2Al+3Fe(NO3)2 ==2Al(NO3)3+3Fe,滤渣中一定含有生成的Fe,很可能含有铝,所以A的成分可能是银、铜、铁、铝。分析思考:猜想Ⅰ一定不正确,原因是滤液是无色溶液,说明硝酸亚铁和铝完全反应生成硝酸铝和铁,因此滤渣A中一定含有生成的铁。进行实验:Fe +2HCl== FeCl2+H2↑,稀盐酸是无色溶液,FeCl2溶液是浅绿色,所以实验现象是溶液由无色变为浅绿色。作出判断:银、铜、铁、铝四种金属中,只有铝可以和氢氧化钠溶液反应,生成氢气,如果现象b为“产生气泡,固体部分溶解”,则说明固体中有铝,猜想Ⅲ成立;如果现象b为不产生气泡,固体不溶解,说明滤渣中不含有铝,则猜想Ⅱ成立。

【题目】已知硝酸钾在不同温度下的溶解度如表:
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
溶解度(g/100g 水) | 32 | 46 | 64 | 85.5 | 110 | 138 | 170 |
甲是 80℃含有 100g 水的 KNO3 溶液,操作过程如图所示。以下分析错误的是( )
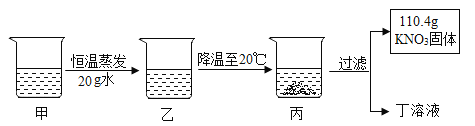
A. 甲一定是不饱和溶液,乙可能饱和溶液
B. 甲乙丙丁溶液中溶质的质量分数关系式乙>甲>丙=丁
C. 甲溶液中,溶剂与溶质的质量比为 25:34
D. 甲溶液冷却时,开始析出固体的温度在 60℃~70℃之间
【题目】含碳元素的物质在自然界中普遍存在.请回答下列问题:
(1)已知碳元素的原子结构示意图为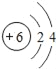 ,其最外层电子数为_____.
,其最外层电子数为_____.
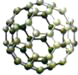
(2)请根据下图提供的信息,在相应的位置上写出不同单质的名称或化学式:
名称:_____ | 化学式:_____ | 名称:_____ |
可用于制铅笔芯 |
分子结构 |
单质图片 |
(3)近几十年来,大气中CO2的含量不断上升,使全球变暖.导致大气中CO2含量不断上升的主要因素是(填写序号)_____.
①人和动物的呼吸 ②植物的光合作用 ③化石燃料的大量使用和森林遭到破坏.