题目内容
【题目】在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体。某兴趣小组请你参与研究:铁与水蒸气反应一段时间后剩余固体物质的成分、性质和利用。实验装置如下图所示(夹持仪器略)
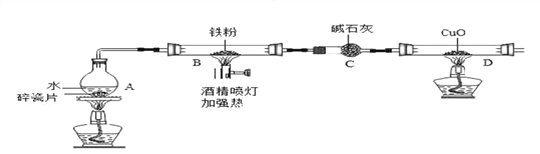
(推断) 观察到D中的黑色固体变红,则B中生成的气体是_______;
(实验探究) B装置中的剩余固体是什么?
(查阅资料)(1)碎瓦石能防止爆沸,碱石灰是氧化钙和氢氧化钠的混合物;
(2)铁的氧化物中,只有Fe2O3是红棕色,其余均为黑色,只有Fe3O4能被磁铁吸引;
(初步探究) B装置中剩余固体为黑色,能全部被磁铁吸引
(猜想和假设)
猜想一:剩余固体是Fe3O4;
猜想二:剩余固体是___________;
(实验探究)
实验操作 | 实验现象 | 实验结论 |
取少量黑色固体于试管中,加入足量的稀盐酸; | ____________ | 则猜想二正确 |
(实验结论)铁与水蒸气反应的化学方程式为_________________________________。
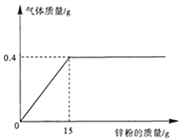
(成分再利用)若将B装置中剩余的黑色固体ag,经过一系列转化,全部变为红棕色固体Fe2O3(假设转化过程中铁元素无损耗),增加的质量为x,则x的取值范围为_____________。(用a来表示,精确到0.01)
【答案】 氢气 Fe 和 Fe3O4 固体全部溶解,并有气泡冒出 Fe+4H2O══Fe3O4+4H2 0.03a≤ x< 0.43a
【解析】(1)观察到D中黑色固体变红,则B中生成的气体具有还原性,再根据反应物为“铁与水蒸气”,所以该气体是氢气;(2)【猜想与假设】能被磁铁吸引的只有Fe与Fe3O4,则猜想一Fe3O4;又不可能只有Fe没有其他反应产物,猜想二是Fe与Fe3O4;验证猜想一与猜想二,关键是否含有Fe,故猜想二:剩余固体是:Fe与Fe3O4;【实验探究】根据铁与稀盐酸反应产生气体,进行设计实验:若固体全部溶解,有气泡冒出,则猜想二正确;【实验结论】根据“在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体”和猜想,所以铁和水蒸气反应会生成四氧化三铁和氢气,化学方程式为:3Fe+4H2O![]() Fe3O4+4H2;(3)假设黑色固体全是铁,则
Fe3O4+4H2;(3)假设黑色固体全是铁,则
3Fe-----Fe2O3 质量增加
112 160 48
ag x
则x=0.43a
假设黑色固体全部是四氧化三铁,则
2Fe3O4------3Fe2O3 质量增加
464 480 16
ag x
则x=0.03a,根据猜想,所以x的取值范围为0.03a≤x<0.43a。

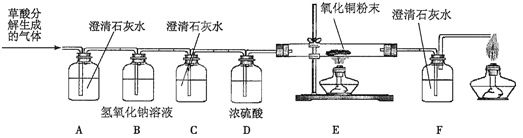
【题目】在浓硫酸的作用下,固体草酸(H2C2O4)受热分解生成碳的氧化物和水。某化学课外兴趣小组对碳的氧化物的成分进行了实验探究。
(提出问题)如何通过实验确定碳的氧化物的成分。
(猜 想)
猜想1 | 猜想2 | 猜想3 |
只有CO | 只有_____________ | CO和CO2都有 |
(设计实验)基于猜想3,兴趣小组同学设计了如下实验装置:
(实验探究)
(1)实验过程中观察到_________装置(填字母)中的澄清石灰水变浑浊,证明有CO2气体;
(2)实验过程中还观察到以下实验现象:①C装置中澄清石灰水不变浑浊;②E装置中黑色粉末变成红色;③___________________,证明有CO气体;
(实验结论)通过实验探究证明:猜想3成立
草酸分解的化学方程式是_____________________________________;
(问题讨论)
C装置的作用是_______________________;D装置的作用是_______________________。