题目内容
【题目】下列图象能正确反应其对应实验操作的是
A. 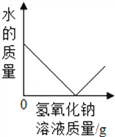 向一定量的硫酸溶液中,滴加过量的氢氧化钠溶液
向一定量的硫酸溶液中,滴加过量的氢氧化钠溶液
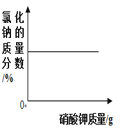
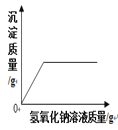
B. 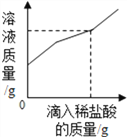 向一定量的部分变质的氢氧化钠溶液中,滴加过量稀盐酸
向一定量的部分变质的氢氧化钠溶液中,滴加过量稀盐酸
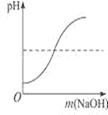
C. 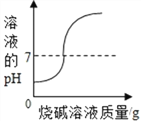 向一定量的烧碱溶液中不断加稀硫酸
向一定量的烧碱溶液中不断加稀硫酸
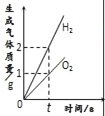
D. 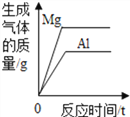 将等质量的镁粉和铝粉分别与足量等浓度的稀盐酸反应
将等质量的镁粉和铝粉分别与足量等浓度的稀盐酸反应
【答案】B
【解析】A、向一定量的硫酸溶液中,滴加过量的氢氧化钠溶液,水的质量会越来越多,错误;B、向一定量的部分变质的氢氧化钠溶液中,滴加过量稀盐酸,则开始是氢氧化钠和盐酸反应,当氢氧化钠完全反应,则是碳酸钠和盐酸反应,生成二氧化碳,则溶液质量增加的速度变慢,正确;C、向一定量的烧碱溶液中不断加稀硫酸,溶液pH逐渐接近于7,当氢氧化钠与硫酸完全反应pH=7,继续加入稀硫酸,pH小于7,错误;D、将等质量的镁粉和铝粉分别与足量等浓度的稀盐酸反应,铝产生的氢气的质量大,错误。故选B。

 阅读快车系列答案
阅读快车系列答案【题目】下列图像能正确反映对应变化关系的是
|
|
|
|
A.电解水产生氢气与氧气 | B.向氯化钠的饱和溶液中加入硝酸钾 | C.向混有少量硫酸的硫酸铜溶液中加入氢氧化钠溶液 | D.向一定质量的稀盐酸中加氢氧化钠 |
A. A B. B C. C D. D
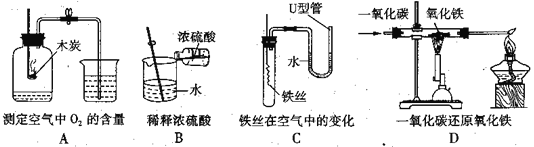
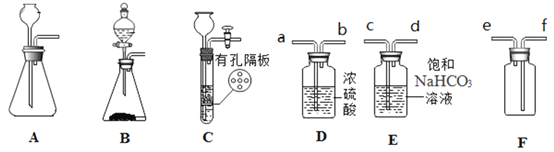
【题目】在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体。某兴趣小组请你参与研究:铁与水蒸气反应一段时间后剩余固体物质的成分、性质和利用。实验装置如下图所示(夹持仪器略)
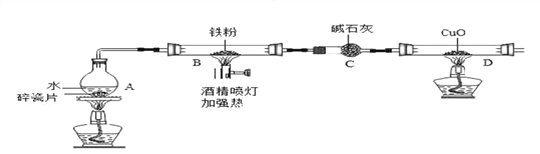
(推断) 观察到D中的黑色固体变红,则B中生成的气体是_______;
(实验探究) B装置中的剩余固体是什么?
(查阅资料)(1)碎瓦石能防止爆沸,碱石灰是氧化钙和氢氧化钠的混合物;
(2)铁的氧化物中,只有Fe2O3是红棕色,其余均为黑色,只有Fe3O4能被磁铁吸引;
(初步探究) B装置中剩余固体为黑色,能全部被磁铁吸引
(猜想和假设)
猜想一:剩余固体是Fe3O4;
猜想二:剩余固体是___________;
(实验探究)
实验操作 | 实验现象 | 实验结论 |
取少量黑色固体于试管中,加入足量的稀盐酸; | ____________ | 则猜想二正确 |
(实验结论)铁与水蒸气反应的化学方程式为_________________________________。
(成分再利用)若将B装置中剩余的黑色固体ag,经过一系列转化,全部变为红棕色固体Fe2O3(假设转化过程中铁元素无损耗),增加的质量为x,则x的取值范围为_____________。(用a来表示,精确到0.01)
【题目】某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸。NaOH和Ca(OH)2的市场价格如表:
名称 | Ca(OH)2 | NaOH |
价格(元/kg) | 6.00 | 24.00 |
(1)若要清洗50kg这种石油产品,需要__________gNaOH?(写出计算步骤)
(2)石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。每处理50kg这种产品,可以节约______________元经费?