题目内容
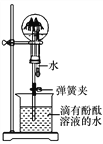
【题目】(8分)某化学兴趣小组同学欲测定某铁粉与碳粉混合物中铁的质量分数,他们进行了如图所示的实验。请计算:

(1)混合物中铁的质量。
(2)反应后烧杯中稀硫酸无剩余,请计算所用稀硫酸溶液中溶质的质量分数。
(3)欲用98%的浓硫酸配制该浓度的稀硫酸200g,需要水的质量是多少?
【答案】解:(1)混合物中铁的质量为10g-4.4g=5.6g。
(2)生成氢气的质量为50g+10g-55.4g-4.4g=0.2g,设稀硫酸中溶质的质量为x。
Fe+H2SO4===FeSO4+H2↑
98 2
x 0.2g
![]() =
=![]() x=9.8g
x=9.8g
所用稀硫酸溶液中溶质的质量分数为![]() ×100%=19.6%。
×100%=19.6%。
(3)欲用98%的浓硫酸配制该浓度的稀硫酸200g,设需要水的质量为y。
(200g-y)×98%=200g×19.6%
y=160g
答:(1)混合物中铁的质量为5.6g;(2)所用稀硫酸溶液中溶质的质量分数为19.6%;
(3)欲用98%的浓硫酸配制该浓度的稀硫酸200g,需要水160g。
【解析】试题分析:(1)由于混合物是铁粉与碳粉,铁可以与稀硫酸反应变为可溶性的FeSO4,碳粉不能发生反应,所以混合物中铁的质量是:10g﹣4.4g=5.6g;(2)根据物质在反应前后质量不变,可知反应生成氢气的质量为:50g+10g﹣55.4g﹣4.4g=0.2g,设稀硫酸中溶质的质量为x,根据反应方程式Fe+H2SO4=FeSO4+H2↑可知硫酸与反应产生的氢气的质量关系是98:2,现在反应产生氢气的质量是0.2g,则反应需要硫酸的质量是![]() ,解得:x=9.8g。所用稀硫酸溶液中溶质的质量分数是:
,解得:x=9.8g。所用稀硫酸溶液中溶质的质量分数是:![]() =19.6%;(3)欲用98%的浓硫酸配制该浓度的稀硫酸200g,由于溶液在稀释前后溶质的质量不变。设需要水的质量为y,(200g﹣y)×98%=200g×19.6% 解得:y=160g。
=19.6%;(3)欲用98%的浓硫酸配制该浓度的稀硫酸200g,由于溶液在稀释前后溶质的质量不变。设需要水的质量为y,(200g﹣y)×98%=200g×19.6% 解得:y=160g。