题目内容
【题目】某学习小组为探究空气中氧气的含量,设计了如图所示的装置,根据装置回答下列问题:
(1)用放大镜聚焦使燃烧匙中过量的白磷燃烧,当装置冷却到室温时,可观察到U形管右侧水面的变化情况是 __________。
(2)通过这个实验可以得出的结论是 ____________。
(3)反应完毕后,U形管右侧剩余的气体主要是_________。
(4)为什么不能用木炭取代白磷做这个实验?___________________。
【答案】右侧上升氧气约占空气体积的五分之一;氮气;木炭燃烧生成气体
【解析】
(1)白磷燃烧就是白磷和氧气在点燃条件下反应生成五氧化二磷,当装置冷却到室温时,U形管右侧水面上方气体减少,压强变小,小于外界大气压,而左侧液面上方气体压强等于大气压,可观察到U形管水面的变化情况是右侧上升、左侧下降;
(2)冷却至室温后,右侧液面上升的高度为原气体所占高度的五分之一,通过这个实验可以得出的结论是氧气约占空气体积的五分之一;
(3)空气中各成分的含量按体积分数计算,氮气占78%,氧气占21%,反应完毕后,U形管右侧剩余的气体主要是氮气;
(4)不能用木炭取代白磷做这个实验,因为木炭燃烧生成气体二氧化碳,装置内气体不减少,压强不变小,液面没有变化,不能测定氧气的含量。

【题目】下图为某钙片标签上的部分文字,请仔细阅读后回答下列问题。
(1)维生素D种类较多,其中维生素D2的化学式为C28H44O,试计算:
①维生素D2的相对分子质量________________;
②维生素D2中碳、氢、氧三种元素的质量比________________;
(2)计算每片钙片中含碳酸钙(CaCO3)的质量。_____________
(主要原料)碳酸钙、维生素D (功效成分)补钙 |
每片含钙(以Ca计)500 mg、维生素D100ug (食用方法)每日一次,每次一片 (规 格)2.5g/片 |
【题目】小婧同学学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体。但她在空气中点燃镁条时,却发现在生成的白色固体中还夹杂着少量的淡黄色固体。
[提出问题]为什么会生成淡黄色固体?
[查阅资料]小婧查阅资料,记录了下列几种物质的颜色:
物 质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
颜 色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
其他同学认为不必查阅氯化镁的颜色,理由是___________________________;
同时小婧还查阅到:镁可以在CO2中燃烧,生成氧化镁和一种黑色固体。你认为黑色固体是________
[提出猜想]分析资料,小婧认为淡黄色固体可能是由镁与空气中的______反应生成的;
[实验探究]小婧设计实验证实了自己的猜想,她的方案可能是________________;
[实验结论]根据小婧的实验结果,写出镁条在空气中燃烧时两个反应的化学方程式:_________ 、_____
[反思与评价]通过上述实验和有关资料,你对燃烧及灭火有什么新的认识?(写出2点)____________、_________________。
【题目】某小组对 H2O2 溶液制取氧气进行了如下探究:
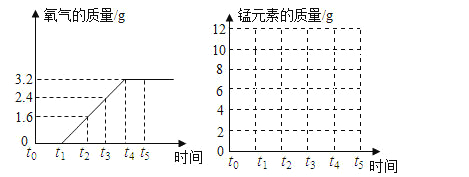
(探究一)探究不同催化剂对 H2O2分解速率的影响该小组采用了如下图所示装置进行实验,实验中催化剂均为0.4g,H2O2溶液均为20mL,浓度均为 10%。在C框中连接导管和量筒,并测量收集到 50mL 水时的某项数据, 经计算后绘制出下表:
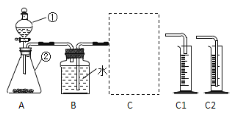
(1)检查 A 装置气密性的方法是:用弹簧夹夹住 A 装置右侧胶皮管,打开①上方的塞子, 向其中加水,打开①的活塞,若__________,则气密性良好。
(2)C 框内选用C1或C2装置,对该探究实验结论有无影响__________。
(3)从实验数据可知:相同条件下,表中催化剂的催化效果由强到弱依次为______。
催化剂种类 | 气体产生速率(mL/s) |
二氧化锰 | 3.5 |
氧化铜 | 4.5 |
活性炭 | 5.8 |
(4)该探究实验中,需要测定的数据是__________。
(5)当量筒中收集到 50mL 水时,H2O2分解产生的氧气体积______50mL(填“大于”、 “等于”、“小于”)。
(探究二)探究 MnO2 的用量对H2O2分解速率的影响下图甲所示装置中产生氧气的量可以用压强传感器测出(在等温条件下,产生氧气体积与装置内压强成正比。反应放热忽略不计)
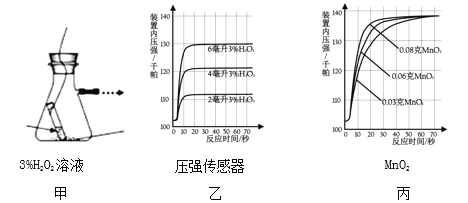
(1)图乙是“0.1gMnO2 与不同体积的 3%H2O2 溶液混合”的实验结果,从图中可以看出______________________。
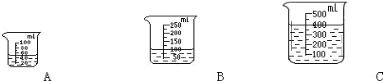
(2)当用“3%H2O2 溶液 8 毫升与不同质量的 MnO2 混合”时,得到如图丙所示的曲线。曲线的斜率显示,当 MnO2 的用量增加到 0.08g 时,H2O2 的分解速率达到实验要求。在此实验条件下,若MnO2的质量为4g(一药匙)时,能使下图____ (选填字母)烧杯中所装的3%H2O2溶液中 H2O2 的分解速率最接近实验要求。
(探究三)探究 H2O2 溶液的浓度对 H2O2 分解速率的影响如图所示,在250mL三颈瓶中均加入0.5gMnO2,在恒压漏斗中各加入20mL不同浓度的 H2O2 溶液,分别进行实验。用温度传感器测量并绘制出瓶内温度与时间的关系图。如下图 1 所示。再将该装置的三颈瓶浸入水浴池中(该池可使瓶内的溶液温度恒定在 20℃),用上述实验中相同量的各物质重复上述实验,用气压传感器测量并 绘制出瓶内气压与时间的关系图,如下图 2 所示。

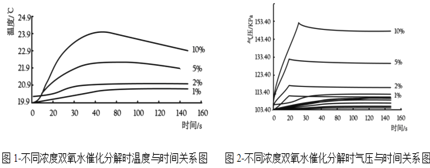
不同浓度双氧水催化分解时温度与时间关系图,图 2-不同浓度双氧水催化分解时气压与时间关系图
(1)实验中,恒压漏斗的作用是__________。
(2)由图 1 知道:H2O2分解时会__________热量(填“放出”或“吸收”)。
(3)由图2知道:H2O2溶液浓度越高,H2O2 分解速率越______(填“快”或“慢”)。 以 10%H2O2 溶液为例,约 25S 后三颈瓶内气压由高缓慢降低的原因是_______。
(4)影响 H2O2 分解速率的因素,除了催化剂的种类、催化剂的用量、H2O2 溶液的浓度外,还可能有_______ 、_______等。