题目内容
【题目】如图是某粒子的结构示意图,回答下列问题:
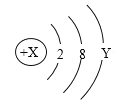
(1)X表示____________ ,Y表示____________;
(2)当X=12时,Y = ____________ ;
(3)当X=17时,该粒子带1个单位负电荷,则Y = ____________;
(4)当Y=1时,该粒子易________(填“得到”或“失去”)电子,变成带 _______(填“正”或“负”)电荷的__________(填“阳离子”或“阴离子”)。
【答案】质子数最外层电子数28失去正阳离子
【解析】
(1)X表示质子数(核电荷数),Y表示最外层电子数;
(2)原子中正电荷数量等于负电荷数量,故当X=12时,Y=12-2-8=2;
(3)当X=17时,该粒子带1个单位负电荷,则核外电子数比质子数多1,故2+8+y=18,解得y=8;
(4)当Y=1时,即最外层电子数小于4,则该粒子易失去电子,变成带正电荷的阳离子。

 智慧课堂密卷100分单元过关检测系列答案
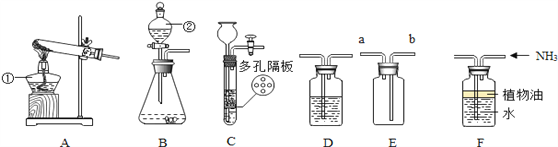
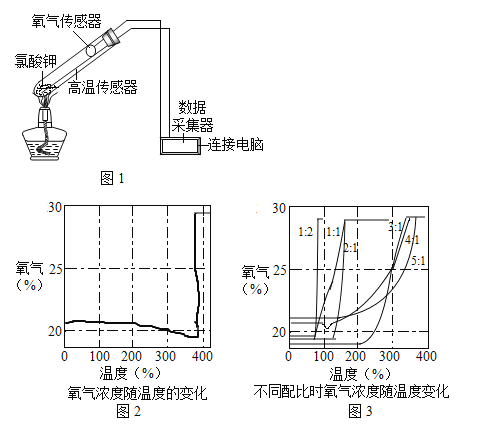
智慧课堂密卷100分单元过关检测系列答案【题目】在老师的指导下,某学习小组利用如图1所示装置对氯酸钾(KClO3)制氧气进行了深入的探究学习。
资料:
①KClO3的熔点约为356℃,MnO2的分解温度约为535℃。用酒精灯物质加热,受热物质的温度一般约为400℃左右;
②不同配比是指KClO3和MnO2混合物中,KClO3和MnO2的质量比;
③氯酸钾分解时,传感器得到氧气浓度随温度的变化示意图及不同配比时氧气浓度随温度的变化示意图如图:
请回答问题:
(1)分析图2KClO3分解温度___(填“高于”、“等于”或“低于”)其熔点。
(2)分析图2在KClO3分解前,传感器得到氧气浓度降低的可能原因是___.
(3)分析图3KClO3分解温度随物质配比变化的规律是___,当物质配比为1:2是KClO3分解温度约为___℃。
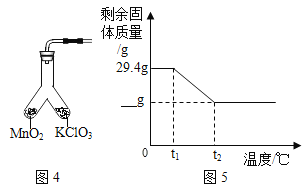
(4)为证实MnO2的催化作用,小组同学利用如图4装置进行如表所示的实验:
步骤 | 实验操作 | 实验现象 |
Ⅰ | 检查气密性 | |
Ⅱ | 分别在“Y”形管两侧支管中加入少量MnO2和KClO3,塞紧橡皮塞 | ________ |
Ⅲ | 分别先后加热MnO2和KClO3,用带火星木条放在导管口。加热___(填“左”或“右”)侧支管后,带火星木条复燃 | ________ |
Ⅳ | 冷却后,将“Y”形管左侧支管中部分MnO2混入右侧支管中,振荡“Y”形管,加热,用带火星木条放在导管口 | ________ |
请回答:
①完善步骤Ⅲ中的填空:
②步骤Ⅳ中,将MnO2混入右侧支管有余热的KClO3中的操作方法是___.
③步骤Ⅳ的实验现象能否说明MnO2是KClO3分解的催化剂___(填“能”或“不能”),如不能,还需证明在此反应中MnO2的___和___不变。
(5)将29.4gKClO3和MnO2混合物以5:1配比加热至完全反应,如图5中的值应为___。
A.4.9B.9.6C.14.9D.19.8.
【题目】人教版新化学教材关于“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
(实验探究)
实验步骤 | 实验现象 |
Ⅰ.分别量取5mL5%过氧化氢溶液放入A、B两支试管中,向A试管中加入ag氧化铁( Fe2O3)粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象。 |
Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次实验,观察现象。 | 试管中均产生气泡,带火星木条均复燃。 |
Ⅲ.将实验Ⅱ中的剩余物小心过滤,并将所得虑渣进行洗涤、干燥、称量,所得固体质量仍为ag。 | |
Ⅳ.分别量取5mL5%过氧化氢溶液放入C、D两支试管中,向C试管中加入ag氧化铁粉末.向D试管中加入ag二氧化锰粉末,观察现象。 |
(实验结论)
(1)A中产生的气体是______。
(2)实验Ⅱ、Ⅲ证明:氧化铁(Fe2O3)的_____和________在反应前后均没有发生变化,可以作过氧化氢分解的催化剂。
(3)写出氧化铁(Fe2O3)催化过氧化氢分解的化学符号表达式___________。
(实验评价)
(1)设计实验Ⅳ的目的是__________________________。
(2)若实验Ⅳ观察到D试管中产生气泡的速率更快,由此你可以得到的结论是_______。
(实验拓展)
查阅资料得知:CuO、CuSO4、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是____。
A.MnO2只能作为过氧化氢溶液分解的催化剂
B.同一个化学反应可以有多种催化剂
C.催化剂只能加快化学反应的速率
D.用作催化剂的物质不可能是其它反应的反应物或生成物