题目内容
【题目】
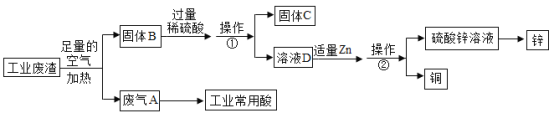
碳酸钙可用于预防和治疗钙缺乏症。某实验小组同学要测定一种钙片中碳酸钙的含量。
(查阅资料)获得的资料有:
补钙剂中常加入糖类、维生素D等改善口感或增强药效。这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解。
碳酸钙高温灼烧分解生成氧化钙和二氧化碳。
常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量。
澄清石灰水中的Ca(OH)2含量很少,100 g澄清石灰水中最多含0.15 g Ca(OH)2。
(方案设计和实施)根据资料和已学知识,该小组同学设计如下两种方案进行测定。
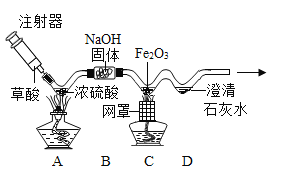
方案1:根据下图所示装置实验。
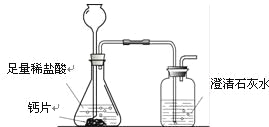
(1)锥形瓶中发生反应的化学方程式为 。
(2)长颈漏斗下部插入液面下的目的是 。
(3)加入药品前,检验该装置气密性的方法是 。
(4)记录数据如下:
钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
25 g | 100 g | 200 g | 300.4 g |
方案2:将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量。记录数据如下(空烧杯质量为100 g,加入钙片质量为25 g):
加入稀盐酸的质量 | 100 g | 200 g | 300 g | 400 g |
充分反应后烧杯及杯内物质总质量 | 222.8 g | 320.6 g | 418.4 g | 518.4 g |
(分析和评价)
(1)方案1和方案2中合理的是 ,原因是 。
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是 。
(3)要使用(查阅资料)(3)中介绍的方法,还需要学习的是 。
(结论)经过计算,该钙片中碳酸钙的质量分数是 。
【答案】【方案设计和实施】
(1)CaCO3+ 2HCl ="==" CaCl2+ H2O + CO2↑ ………………………………1分
(2)防止CO2气体逸出(液封) ……………………………………………1分
(3)夹住胶管(堵住导管出口),从长颈漏斗加水至长颈漏斗中液面高于锥形瓶内液面,若一段时间不下降,则证明该装置气密性良好(必须答出操作、现象和结论才给分;答“先将长颈漏斗下部液封,将出口导管置于液面下,加热锥形瓶或用手捂住锥形瓶,有气泡产生,则证明该装置气密性良好”也给分) ……………………1分
【分析和评价】
(1)方案2 …………………………………………1分
澄清石灰水中的Ca(OH)2含量很少(不足),吸收的二氧化碳量很少(建议答出因果关系) …………………………………………1分
(2)加入的糖类、维生素D等物质高温灼烧时会燃烧或分解,导致最终的数据偏大(建议答出因果关系) ……………………………1分
(3)如何测定未知浓度(剩余)盐酸的量 ………………………………1分
【结论】有实验记录可知:加入300g盐酸时碳酸钙已完全反应,生成二氧化碳的质量为,(300+100+25)-418.4=6.6g
设xg碳酸钙与盐酸完全反应生成6.6g二氧化碳.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
xg 6.6g
100/ 44 ="x" /6.6
x=15
钙片中碳酸钙的质量分数为15/25 ×100%=60%.
60%
【解析】
通过资料:补钙剂中的糖类、维生素D等,这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解,根据碳酸钙与稀盐酸反应生成二氧化碳的质量来测定钙片中碳酸钙的含量.

 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
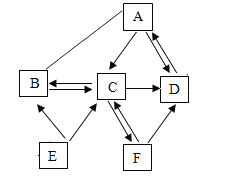
互动课堂系列答案【题目】某校化学兴趣小组的同学利用下图所示进行实验
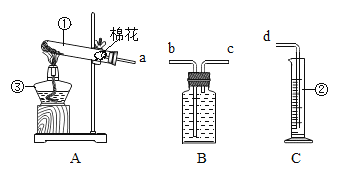
(1)仪器名称 ①___________ ②___________ ③___________
(2)实验目的:① 学习用高锰酸钾制氧气 ② 探究使带火星的木条复燃的气体中氧气含量的极限
(3)反应原理:高锰酸钾制氧气的化学反应表达式___________________;
(4)装置连接:为了测出所收集氧气的体积,各装置的正确连接顺序是(填接口的字母)
(____________)→(___________)→(___________)→(____________)
(5)问题用收集到的氧气做细铁丝燃烧的实验时,实验结束后,发现试管底部破裂,可能的原因是_________。
(6)某学生将带火星的木条伸入盛有氧气的集气瓶中,带火星的木条没有复燃,分析原因回答两条____________________、_______________。
(7)该兴趣小组为了探究使带火星的木条复燃的气体是否一定为纯净氧气?若不是,则访项实验中氧气含量的极限是多少?为此,他们按下表所示比例,用排水法收集氧气进行实验。
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
空气体积分数/% | 50 | 70 | 75 | 80 | 85 |
排水体积分数/% | 50 | 30 | 25 | 20 | 15 |
带火星木条复燃情况 | 复燃 | 复燃 | 复燃 | 火星明亮,时燃时不燃 | 火星稍变明亮,不复燃 |
结论:①该实验说明使带火星的木条复燃的氧气____________(填“一定”或“不一定”)是纯氧气。
②氧气的体积分数大于________时,就能使带火星的木条复燃。