题目内容
【题目】如图微型实验装置可用来制取CO模拟工业炼铁并检验气体产物。( 提示:草酸( H2C2O4)在浓硫酸存在并加热的条件下,可分解生成一氧化碳、二氧化碳和水。)
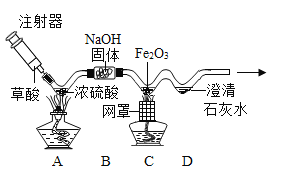
(1)写出C中发生反应的化学方程式_____。
(2)D中观察到的实验现象是什么_____?
(3)从环保角度考虑,对该装置的改进措施是什么_____?
(4)请设计实验方案证明该实验结束后固体B已经全部失效_____。
【答案】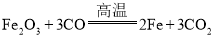 澄清石灰水变浑浊 在D装置之后增加酒精灯将尾气点燃(或用气球收集) 取B中固体于试管中,加足量水溶解,滴加过量的BaCl2溶液,有白色沉淀产生,静置,向上层清液中滴加酚酞,溶液不变红(或不变色),则证明全部失效
澄清石灰水变浑浊 在D装置之后增加酒精灯将尾气点燃(或用气球收集) 取B中固体于试管中,加足量水溶解,滴加过量的BaCl2溶液,有白色沉淀产生,静置,向上层清液中滴加酚酞,溶液不变红(或不变色),则证明全部失效
【解析】
(1)草酸( H2C2O4)在浓硫酸存在并加热的条件下,可分解生成一氧化碳、二氧化碳和水,混合气体通过B,二氧化碳被氢氧化钠吸收,三氧化二铁在高温的条件下可和一氧化碳反应生成铁和二氧化碳,其化学反应方程式为: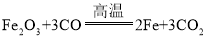 ;
;
(2)C中有二氧化碳产生,二氧化碳可使澄清石灰水变浑浊,故D中观察到的实验现象是澄清石灰水变浑浊;
(3)一氧化碳有毒,未反应的一氧化碳排到空气中会污染空气,故应增加尾气处理装置,可在D装置之后增加酒精灯将尾气点燃(或用气球收集);
(4)氢氧化钠会和二氧化碳反应生成碳酸钠和水,故设计实验方案证明该实验结束后固体B已经全部失效的方法:取B中固体于试管中,加足量水溶解,滴加过量的BaCl2溶液,有白色沉淀产生(说明生成了碳酸钠),静置,向上层清液中滴加酚酞,溶液不变红(说明无氢氧化钠),则证明全部失效。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
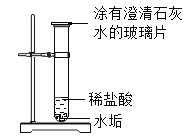
全优冲刺100分系列答案【题目】某饮用水中含有较多的碳酸氢钙:Ca(HCO3)2 ,因此此水属于___水,煮沸时会有水垢生成。实验小组欲探究该水垢的主要成分:
(猜想与分析)分析Ca(HCO3)2与水的元素组成,该水垢的主要成分可能是:
Ⅰ:CaO ; Ⅱ:Ca(OH)2 ;Ⅲ:CaCO3 ; Ⅳ:Ca(OH)2和CaCO3 。
小强同学认为该水垢中不会存在CaO,因为氧化钙会与水反应_________(用化学方程式表示)。
(实验与事实)
实验 | 实验现象 | 解释或结论 |
1.将适量的水垢和水装入试管中,充分振荡后静置,取上层清液于试管中,通入CO2 | 不变浑浊 | 说明水垢中一定没有______。 |
2. | 有气泡产生,玻璃片上澄清石灰水变_______。 | 说明有CO2生成。则水垢中一定含有_________。 |
(实验启示)根据实验2,生活中除去热水瓶胆内沉积的水垢可用的物质有_________。
A 食盐水(中性) B 食醋(酸性) C 洗洁精(碱性) D 洁厕灵(酸性)
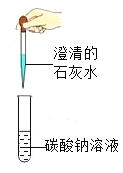
【题目】一种名为“污渍爆炸盐”的洗涤产品能高效去除衣物上的顽固污渍,某校化学研 究性学习小组的同学在老师的指导下对该产品开展了以下探究活动。
(查阅资料)“污渍爆炸盐”的主要成分是过碳酸钠(相对分子质量为 122),它是一种白 色固体粉末,易溶于水且能与水反应生成一种碳酸盐和一种强氧化性的物 质,是当前使用最为广泛的洗涤助剂之一。
(实验探究一)过碳酸钠的化学组成
为探究过碳酸钠的化学组成,同学们设计了以下实验,请按要求完成表格内容:
序号 | 实验步骤 | 实验现象 | 实验分步结论(或解释) |
① | 向盛有过碳酸钠固体的试管中加入适量水 向所得溶液中加入适量 的二氧化锰粉末 | 固体溶解,有大量气泡 产生 | 过碳酸钠可溶于水,并且能与水反应。 |
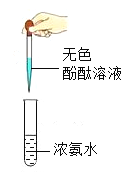
② | 将带火星的木条置于试 管口 | 木条复燃 | 在试管中产生的气体是_______;过碳酸钠溶于水能生成___________(填化学式)。 |
③ | 取序号③试管中的上层清液加入氯化钙溶液 | 产生白色沉淀 | 反应的化学方程式:___________。 |
小结 | 过碳酸钠的化学式是_________;过碳酸钠与水反应的化学方程式是______。 | ||
(实验探究二)过碳酸钠含量测定
老师给同学们一份含碳酸钠杂质的过碳酸钠样品(不含其它杂质),要求设计方案测定 该样品中过碳酸钠的含量,同学们经讨论设计了如下图所示的实验装置。图中装置 B 盛装 氢氧化钠溶液、C 盛装澄清石灰水、D 盛装浓硫酸,E、F 均装入干燥的碱石灰(主要成分: 氧化钙和氢氧化钠的固体混合物;可吸收二氧化碳和水蒸气)

(1)首先关闭活塞 K、K2,打开活塞 K1、K3、K4,通入一段时间的氮气排出锥形瓶中的空气,此时装置 B 的作用是____________;
(2)依次关闭活塞 K1、K3、K4,打开活塞 K2、K,此时锥形瓶中反应生成的气体是__________, 反应完全后关闭活塞 K,再次打开活塞 K1 通入氮气的作用是__________;
(3)同学们根据 E 装置在测定前后的质量差计算出了样品中过碳酸钠的含量。装置 F 的作用是__________。
【题目】
碳酸钙可用于预防和治疗钙缺乏症。某实验小组同学要测定一种钙片中碳酸钙的含量。
(查阅资料)获得的资料有:
补钙剂中常加入糖类、维生素D等改善口感或增强药效。这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解。
碳酸钙高温灼烧分解生成氧化钙和二氧化碳。
常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量。
澄清石灰水中的Ca(OH)2含量很少,100 g澄清石灰水中最多含0.15 g Ca(OH)2。
(方案设计和实施)根据资料和已学知识,该小组同学设计如下两种方案进行测定。
方案1:根据下图所示装置实验。
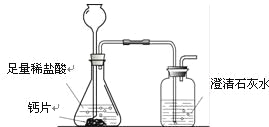
(1)锥形瓶中发生反应的化学方程式为 。
(2)长颈漏斗下部插入液面下的目的是 。
(3)加入药品前,检验该装置气密性的方法是 。
(4)记录数据如下:
钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
25 g | 100 g | 200 g | 300.4 g |
方案2:将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量。记录数据如下(空烧杯质量为100 g,加入钙片质量为25 g):
加入稀盐酸的质量 | 100 g | 200 g | 300 g | 400 g |
充分反应后烧杯及杯内物质总质量 | 222.8 g | 320.6 g | 418.4 g | 518.4 g |
(分析和评价)
(1)方案1和方案2中合理的是 ,原因是 。
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是 。
(3)要使用(查阅资料)(3)中介绍的方法,还需要学习的是 。
(结论)经过计算,该钙片中碳酸钙的质量分数是 。