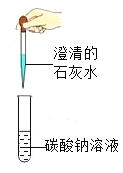
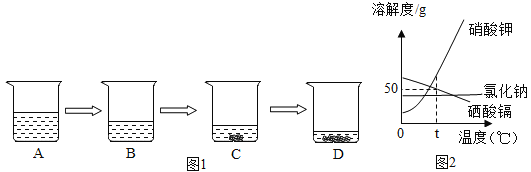
题目内容
【题目】(1)2019年3月22日是第27届世界水日,宣传主题是“Leaving no one behind" (不让任何一个人掉队)。水对于生存至关重要,我们的身体、城市、工业、农业乃至生态系统都依赖于它。请回答下列与水有关的问题。
①公共场所的直饮水是利用“活性炭+超滤膜+紫外线”的组合工艺获得,利用了活性炭的______________________性,
也有很多人会饮用pH在7.5 ~8.5之间的苏打水,这种水呈_____________性。
②自来水厂经过滤、杀菌消毒后,取水样向其中加人适量肥皂水,振荡,发现水中出现的浮渣较多、泡沫较
少,则该水样为___________________________(填“硬水”或“软水”),经过以上处理的自来水不是纯水,若要制取纯水,应采取的净化方法是___________________________。
③爱护水资源,一方面要节约用水,另一方面要防治水体污染,下列符合节约用水的是___________________________(填字母)。
A.改漫灌为滴灌或喷灌
B.用洗菜、淘米后的水浇花
C.刷牙时,不关闭水龙头
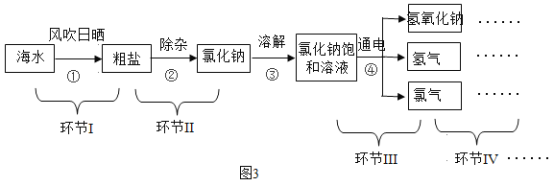
(2)实验室常用如图所示装置来测定空气中氧气的含量,该实验对红磷的要求是___________________________,集气瓶底部放少量水的作用一方面是吸收反应生成的五氧化二磷,防止污染空气,另一方面是______________________。
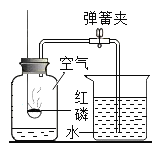
(3)实验室电解水时,一段时间后,正、负极产生气体的体积比约为___________________________,该实验说明水是由________组成的。
(4)日常生活中,用洗涤剂可除去餐具上的油污,是因为洗涤剂具有____________________作用。
【答案】吸附 碱 硬水 蒸馏 AB 红磷要过量 使装置 内温度迅速冷却至室温 1:2 氢元素和氧元素 乳化
【解析】
(1)①活性炭具有吸附性,可除去水中的色素和异味;pH>7的溶液显碱性,苏打水pH大于7,故其显碱性。
②向水样中加人肥皂水振荡后,出现泡沫较少、浮渣较多的现象,则说明该水样为硬水;蒸馏是净水程度最高的方法,故可通过蒸馏得到纯水。
③A改漫灌为滴灌或喷灌,有利于节约用水,故选项正确;
B一水多用有利于节约用水,故选项正确;
C不关闭水龙头会造成水资源的浪费,故选项错误。
故选:AB。
(2)该实验过程中需要红磷过量,确保集气瓶中的氧气耗尽,若红磷量不足,会导致瓶内氧气未消耗完,所测氧气含量偏低;水蒸发吸热,使周围温度降低,可使装置内温度迅速冷却至室温。
(3)电解水的实验中正极产生的气体是氧气,负极产生的气体是氢气,正、负极产生气体的体积比约为1:2。由该实验可知,水是由氢元素和氧元素组成的。
(4)由于洗涤剂具有乳化作用,所以日常生活中可用洗涤剂除去餐具上的油污。

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案【题目】一种名为“污渍爆炸盐”的洗涤产品能高效去除衣物上的顽固污渍,某校化学研 究性学习小组的同学在老师的指导下对该产品开展了以下探究活动。
(查阅资料)“污渍爆炸盐”的主要成分是过碳酸钠(相对分子质量为 122),它是一种白 色固体粉末,易溶于水且能与水反应生成一种碳酸盐和一种强氧化性的物 质,是当前使用最为广泛的洗涤助剂之一。
(实验探究一)过碳酸钠的化学组成
为探究过碳酸钠的化学组成,同学们设计了以下实验,请按要求完成表格内容:
序号 | 实验步骤 | 实验现象 | 实验分步结论(或解释) |
① | 向盛有过碳酸钠固体的试管中加入适量水 向所得溶液中加入适量 的二氧化锰粉末 | 固体溶解,有大量气泡 产生 | 过碳酸钠可溶于水,并且能与水反应。 |
② | 将带火星的木条置于试 管口 | 木条复燃 | 在试管中产生的气体是_______;过碳酸钠溶于水能生成___________(填化学式)。 |
③ | 取序号③试管中的上层清液加入氯化钙溶液 | 产生白色沉淀 | 反应的化学方程式:___________。 |
小结 | 过碳酸钠的化学式是_________;过碳酸钠与水反应的化学方程式是______。 | ||
(实验探究二)过碳酸钠含量测定
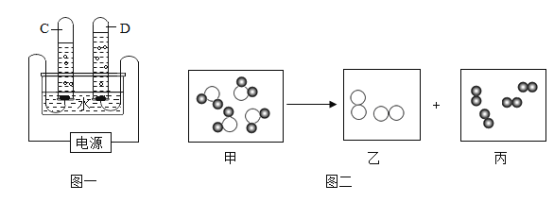
老师给同学们一份含碳酸钠杂质的过碳酸钠样品(不含其它杂质),要求设计方案测定 该样品中过碳酸钠的含量,同学们经讨论设计了如下图所示的实验装置。图中装置 B 盛装 氢氧化钠溶液、C 盛装澄清石灰水、D 盛装浓硫酸,E、F 均装入干燥的碱石灰(主要成分: 氧化钙和氢氧化钠的固体混合物;可吸收二氧化碳和水蒸气)

(1)首先关闭活塞 K、K2,打开活塞 K1、K3、K4,通入一段时间的氮气排出锥形瓶中的空气,此时装置 B 的作用是____________;
(2)依次关闭活塞 K1、K3、K4,打开活塞 K2、K,此时锥形瓶中反应生成的气体是__________, 反应完全后关闭活塞 K,再次打开活塞 K1 通入氮气的作用是__________;
(3)同学们根据 E 装置在测定前后的质量差计算出了样品中过碳酸钠的含量。装置 F 的作用是__________。
【题目】
碳酸钙可用于预防和治疗钙缺乏症。某实验小组同学要测定一种钙片中碳酸钙的含量。
(查阅资料)获得的资料有:
补钙剂中常加入糖类、维生素D等改善口感或增强药效。这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解。
碳酸钙高温灼烧分解生成氧化钙和二氧化碳。
常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量。
澄清石灰水中的Ca(OH)2含量很少,100 g澄清石灰水中最多含0.15 g Ca(OH)2。
(方案设计和实施)根据资料和已学知识,该小组同学设计如下两种方案进行测定。
方案1:根据下图所示装置实验。
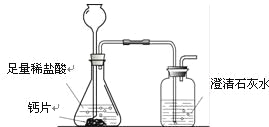
(1)锥形瓶中发生反应的化学方程式为 。
(2)长颈漏斗下部插入液面下的目的是 。
(3)加入药品前,检验该装置气密性的方法是 。
(4)记录数据如下:
钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
25 g | 100 g | 200 g | 300.4 g |
方案2:将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量。记录数据如下(空烧杯质量为100 g,加入钙片质量为25 g):
加入稀盐酸的质量 | 100 g | 200 g | 300 g | 400 g |
充分反应后烧杯及杯内物质总质量 | 222.8 g | 320.6 g | 418.4 g | 518.4 g |
(分析和评价)
(1)方案1和方案2中合理的是 ,原因是 。
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是 。
(3)要使用(查阅资料)(3)中介绍的方法,还需要学习的是 。
(结论)经过计算,该钙片中碳酸钙的质量分数是 。