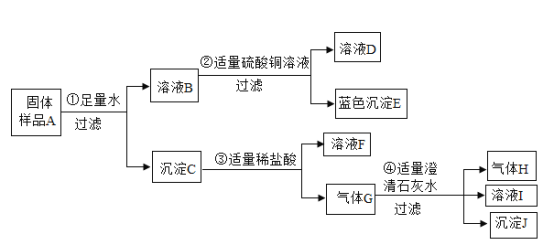
题目内容
【题目】铁、铜和铝是人类生活中常用的金属。
(1)动物细胞中含量最多的金属元素是_____。
(2)用铜、铝做导线,利用了它们的_____性。
(3)铁锅易生锈,铁生锈的条件是_____。
(4)铜器表面会生成铜锈,其主要成分是碱式碳酸铜[Cu2(OH)2CO3],该物质含有_____种元素,从它的化学式可推知,铜生锈的过程除了与氧气和水有关外,还与空气中的_____有关。
(5)除去铜器表面的铜锈时,加入过量的稀硫酸,生成二氧化碳,同时得到蓝色溶液。若再向上述蓝色溶液中加入足量的铁粉,铁粉与蓝色溶液发生反应的化学方程式为_____。
(6)为了验证锌、铁的金属活动性强弱,小琴同学将锌片和铁片同时插入稀硫酸中,而没有插入硫酸铜溶液中,其原因是_____。
(7)小明买了一种“汽泡爽”的冲调饮料,原料中的柠檬酸和小苏打(NaHCO3)粉末混合后加水,可以发生以下反应,3NaHCO3+C6H8O7=C6H5O7Na3+3H2O+3CO2↑.为了探究加水温度对产生气体量的影响,在老师的帮助下,小明采用相同的两套实验装置(如图)分别完成上述实验,在A中加入水,再加入一袋“汽泡爽”,迅速塞紧胶塞。量筒C用于收集A中产生的气体所排出的液体,冷却至室温后读取数据。B中油层的作用是_____。

【答案】钙 导电 铁与氧气、水同时接触 4 二氧化碳(或CO2) Fe+CuSO4═FeSO4+Cu、Fe+H2SO4═FeSO4+H2 将锌片、铁片放入稀硫酸中,锌片放出气泡速度比铁片快,得出锌比铁活泼;若将锌片、铁片放入硫酸铜溶液中,铁、锌与硫酸铜都反应,锌、铁表面都生成红色固体(或锌、铁的现象都相同),无法判断铁是否与硫酸锌反应,所以不能比较锌铁的活动性强弱 防止二氧化碳溶解在水中
【解析】
(1)动物细胞中含量最多的金属元素是钙。
(2)铜、铝具有导电性,可用于制导线。
(3)铁与氧气、水同时接触时会发生锈蚀。
(4)碱式碳酸铜[Cu2(OH)2CO3],该物质含有H、O、Cu、C四种元素,从它的化学式可推知,铜生锈的过程除是金属铜和氧气、水还与空气中的二氧化碳发生化合反应的结果。
(5)碱式碳酸铜[Cu2(OH)2CO3]可以和硫酸反应生成硫酸铜、水以及二氧化碳,加入金属铁,会和硫酸铜之间发生置换反应,即Fe+CuSO4═FeSO4+Cu还会和过量的硫酸之间发生反应Fe+H2SO4═FeSO4+H2↑。
(6)为了验证锌、铁的金属活动性强弱,小琴同学将锌片和铁片同时插入硫酸溶液中,而没有插入硫酸铜溶液中,其原因是:将锌片、铁片放入稀硫酸中,锌片放出气泡速度比铁片快,得出锌比铁活泼;若将锌片、铁片放入硫酸铜溶液中,铁、锌与硫酸铜都反应,锌、铁表面都生成红色固体(或锌、铁的现象都相同),所以不能比较锌铁的活动性强弱。(7)产生的二氧化碳气体是能溶于水的气体,而油层能使二氧化碳与水不接触,从而防止二氧化碳溶于水。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】
碳酸钙可用于预防和治疗钙缺乏症。某实验小组同学要测定一种钙片中碳酸钙的含量。
(查阅资料)获得的资料有:
补钙剂中常加入糖类、维生素D等改善口感或增强药效。这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解。
碳酸钙高温灼烧分解生成氧化钙和二氧化碳。
常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量。
澄清石灰水中的Ca(OH)2含量很少,100 g澄清石灰水中最多含0.15 g Ca(OH)2。
(方案设计和实施)根据资料和已学知识,该小组同学设计如下两种方案进行测定。
方案1:根据下图所示装置实验。
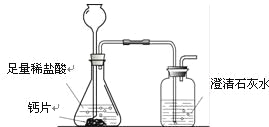
(1)锥形瓶中发生反应的化学方程式为 。
(2)长颈漏斗下部插入液面下的目的是 。
(3)加入药品前,检验该装置气密性的方法是 。
(4)记录数据如下:
钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
25 g | 100 g | 200 g | 300.4 g |
方案2:将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量。记录数据如下(空烧杯质量为100 g,加入钙片质量为25 g):
加入稀盐酸的质量 | 100 g | 200 g | 300 g | 400 g |
充分反应后烧杯及杯内物质总质量 | 222.8 g | 320.6 g | 418.4 g | 518.4 g |
(分析和评价)
(1)方案1和方案2中合理的是 ,原因是 。
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是 。
(3)要使用(查阅资料)(3)中介绍的方法,还需要学习的是 。
(结论)经过计算,该钙片中碳酸钙的质量分数是 。
【题目】下表是氯化钾和硝酸钾在不同温度下的溶解度。根据表中数据,请回答下列问题:
温度/°C | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
KCl | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 | |
(1)在所示的坐标纸上绘制出氯化钾的溶解度曲线______________。
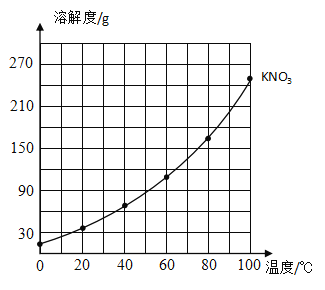
(2)比较两种物质的溶解度曲线,溶解度受温度影响变化较小的是______________,温度大约在___________°C时,两种物质的溶解度大小相等。
(3)60°C时,105g的KNO3饱和溶液中含有的溶质的质量为____________。
(4)40°C时,向烧杯中加入50g水和25gKCl固体,充分溶解后得到的溶液是_____________(填“饱和”或“不饱和”)溶液,其溶质质量分数为_____________(精确到0.1% )。
(5)若KNO3中混有少量的KCl ,提纯KNO3的方法是_____________。