题目内容
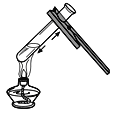
【题目】甲、乙、丙三种物质的溶解度曲线,如图所示,回答下列问题:

(1)P点的含义_____;
(2)当乙中混有少量甲时,可采用_____(填“降温结晶”或“蒸发结晶”)的方法提纯乙。
(3)t2℃时,将甲、乙、丙三种物质的饱和溶液同时降温到t1℃,所得溶液中溶质质量分数由大到小的顺序为_____。
【答案】t1℃时,甲、丙物质的溶解度相等 蒸发结晶 乙>甲>丙
【解析】
(1)由图可知,t1℃时甲、丙的溶解度曲线相交于P点,则P点表示t1℃时,甲、丙物质的溶解度相等,故填t1℃时,甲、丙物质的溶解度相等。
(2)由图可知,甲、乙的溶解度均随温度升高而增大,且甲的溶解度比乙的溶解度受温度影响较大,所以当乙中混有少量甲时,宜采用蒸发结晶的方法来提纯乙,故填蒸发结晶。
(3)由图可知,甲、乙的溶解度均随温度升高而增大,当甲、乙的饱和溶液同时从t2℃降温到t1℃时,两种物质的溶解度都减小,两种溶液都成为t1℃时的饱和溶液,且t1℃时乙的溶解度大于甲的溶解度,所以降温到t1℃时,甲、乙两种溶液的溶质质量分数的关系为:甲<乙,由图可知,丙的溶解度随温度升高而降低,t2℃时,丙的饱和溶液降温到t1℃时,丙的溶解度增大,丙的饱和溶液变为不饱和溶液,溶液中的溶质质量分数不变,且t2℃时丙的溶解度小于t1℃时甲的溶解度,所以t2℃时,丙的饱和溶液降温到t1℃时,得到的丙溶液的溶质质量分数<甲溶液的溶质质量分数,所以t2℃时,将甲、乙、丙三种物质的饱和溶液同时降温到t1℃,所得溶液中溶质质量分数由大到小的顺序为乙>甲>丙,故填乙>甲>丙。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
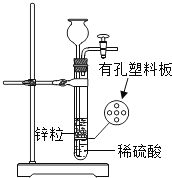
小学生10分钟应用题系列答案【题目】某化学研究小组在学习了“空气中氧气含量测定”实验的基础上,改进了教材中图1的实验,设计了图2的实验装置。
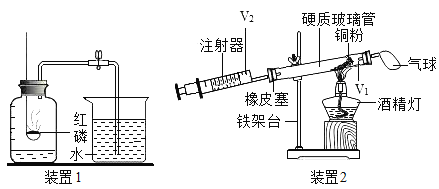
(1)A组同学用图1装置进行实验,红磷燃烧的现象是_____。实验后发现测得的氧气体积分数偏小,原因可能是_____。(填标号)
①红磷燃烧后,燃烧匙伸入不够迅速
②集气瓶没有冷却到室温就打开止水夹
③红磷的量太多
④实验前集气瓶里装水
⑤装置漏气
⑥红磷燃烧时,止水夹未夹紧
(2)B组同学用图2所示装置和药品进行实验,玻璃管容积V1为90mL,注射器的活塞实验前停在30mL处(V2为30mL),操作正确,得出氧气约占空气体积的五分之一,则注射器活塞最终停留在_____mL处,实验过程中,需缓慢推拉注射器活塞,目的是_____,若实验结束且冷却到室温后没有将气球内的气体全部挤出就读数计算,则测量结果会_____(填“偏大”或“偏小”或“不影响”)。
(3)C组同学用图1所示装置,将药品红磷换为木炭测定空气中氧气含量,若实验要成功则需将集气瓶内的水换成_____(填试剂名称)。该小组同学改用新方案进行实验,但发现结果始终偏小。
(提出问题)是什么原因导致测量不准确?
(猜想与假设)他们分别作如下猜想:
甲同学:可能是木炭的量过少;
乙同学:可能是木炭燃烧没有消耗完集气瓶中的氧气;
丙同学:可能是木炭与空气反应生成了其他气体。
(查阅资料)
木炭、棉花和蜡烛在密闭容器内燃烧停止后,残留氧气的体积分数分别高达14.0%,8.0%和16.0%。
(探究一)小组同学发现实验结束后,燃烧匙中还有残留的黑色固体,可知_____同学的猜想不成立。
(探究二)乙同学又利用上述装置设计了如下实验,请你填写下表:
实验步骤 | 实验现象 | 实验结论 |
①将足量木炭点燃,迅速插入装有氧气的集气瓶中 | 木炭燃烧,发出白光,放热 | 乙同学猜想成立 |
②待装置冷却后,将燃着的_____(填“棉花”或“蜡烛”)再伸入集气瓶中 | _____ |
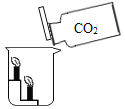
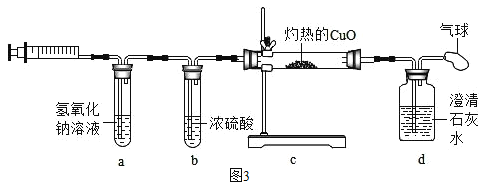
(探究三)丙同学从木炭燃烧产物的角度猜想还可能是生成了_____(填化学式)导致结果偏小;于是用注射器抽取集气瓶内的气体做了如图3所示的实验,气球的作用是_____,当观察到d中_____(填实验现象),可证明丙同学的猜想成立,则c中反应的化学方程式_____。
【题目】某化学小组同学利用盐酸和氧化铜进行实验的过程中,出现了意想不到的现象:发现溶液变为了绿色。为探究溶液变绿的原因,进行系列实验。
(查阅资料)①氧化铜(CuO)为黑色固体②铜离子(Cu2+)在水溶液中呈蓝色
(进行实验)
实验1:取2mL不同浓度的盐酸分别加入到盛有0.2g氧化铜的试管中,进行实验。
序号 | 浓盐酸与水的体积比 | 现象 |
1-1 | 1:1 | 30秒后溶液变为绿色,无黑色固体剩余 |
1-2 | 1:2 | 1分钟后溶液变为蓝绿色,无黑色固体剩余 |
1-3 | 1:3 | 2分钟后溶液变为蓝色,无黑色固体剩余 |
1-4 | 1:4 | 4分钟后溶液变为浅蓝色,有黑色固体剩余且不再减少 |
实验2:取2mL稀盐酸(浓盐酸与水的体积比为1:3)加入到盛有0.2g氧化铜的试管中,实验装置如下。
序号 | 2-1 | 2-2 |
操作 |
|
|
现象 | 2分钟后溶液变为蓝色,无黑色固体剩余 | 10秒后溶液变为浅绿色,无黑色固体剩余 |
(解释与结论)
(1)补全氧化铜与盐酸反应的化学方程式:![]() _____
_____
(2)实验1中配制不同浓度的盐酸时,需要使用的仪器包括_____(填序号,下同)。
A 量筒
B 烧杯
C 玻璃棒
D 酒精灯
(3)实验1的目的是_____。
(4)结合实验1和实验2,得出的结论是_____。
(反思与评价)
(5)实验1-4中,“有黑色固体剩余”的原因是_____。
(6)实验1中若进行浓盐酸与水的体积比为1:5的实验,充分反应后可能出现的现象为_____。
A 溶液变为绿色,无黑色固体剩余
B 溶液变为更浅的蓝色,有黑色固体剩余
C 溶液变为更浅的蓝色,无黑色固体剩余