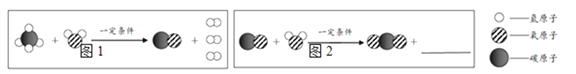
题目内容
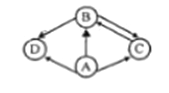
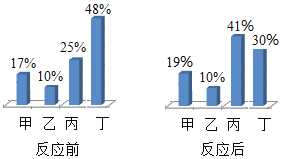
【题目】某同学用如图总结NaOH的四类化学性质(即NaOH能够与四类物质发生化学反应)。
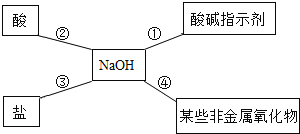
(1)为验证性质①,该同学将无色酚酞试液滴入NaOH溶液中,溶液颜色由无色变成______;
(2)性质②的反应为中和反应,试写出NaOH与盐酸反应的化学方程式______;
(3)为了验证性质③,该同学可选择的物质是______(填序号)。
A Na2CO3 B CO2 C FeCl2 D Ba(NO3)2
【答案】红色 NaOH+HCl=NaCl+H2O C
【解析】
氢氧化钠有四类化学性质:第一类是与指示剂反应,可以使无色酚酞变成红色,紫色石蕊变成蓝色;第二类是与酸发生中和反应,生成盐和水;第三类是与某些盐反应,生成新的盐和新的碱,这类反应属于复分解反应,要根据复分解反应发生的条件来分析,要有沉淀生成;第四类是与某些非金属氧化物反应,生成盐和水,例如二氧化碳、二氧化硫等。
(1)为验证性质①,该同学将无色酚酞试液滴入NaOH溶液中,NaOH溶液显碱性,酚酞滴到碱性溶液中会变成红色,溶液颜色由无色变成红色;
(2)NaOH与盐酸反应生成氯化钠和水,化学方程式为:![]() ;
;
(3)性质③是与盐反应,二氧化碳不属于盐,排除B;氢氧化钠不能和碳酸钠、硝酸钡反应,排除A和D;氢氧化钠能和氯化亚铁反应生成氢氧化亚铁沉淀和氯化钠,因此该同学可选择的物质是氯化亚铁。故填C。

 阅读快车系列答案
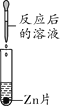
阅读快车系列答案【题目】碳酸钠是苏打的主要成分,在生产和生活中有许多重要的用途。化学课上,同学们为了解碳酸钠的性质,将一定质量的碳酸钠和稀硫酸混合,充分反应后,有气体逸出,写出该反应的化学方程式_________________________________________,同学们对反应后溶液中溶质的成分进行了探究:认为除一定含有硫酸钠外可能还含有其他成分,因此进行了猜想并做了如下实验:
【实验用品】pH试纸、锌片、氧化铜粉末,稀硫酸、氢氧化钠溶液、氯化钡溶液。
【猜想与假设】反应后溶液中溶质的可能组成成分
猜想一: ______________ 猜想二:硫酸钠、碳酸钠 猜想三:硫酸钠、硫酸
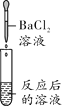
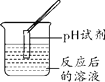
【实验探究】同学们取反应后的溶液用不同方案进行如下实验,请根据结论完成下表实验现象中的①②③。
实验方案 | A | B | C | D |
实验操作 |
|
|
|
|
实验现象 | ______ | 产生白色沉淀 | 试纸变色,对照标准比色卡,pH____7 | ______ |
实验结论 | 猜想二不正确 | 猜想三正确 | 猜想三正确 | 猜想三正确 |
【得出结论】猜想三正确。
【评价反思】(1)老师对同学们能用多种方案进行探究,并且得出正确的实验结论给予了肯定,同时指出探究中存在一处明显操作错误是:_______________________;
(2)有同学对实验方案B的结论提出了质疑,认为仅凭此现象不能得出猜想三正确,请说明理由________________。
【总结提高】依据所给实验用品,设计不同的方案确认猜想三是正确的。请你写出你的实验方案_______________。