题目内容
【题目】为探究盐酸的化学性质,某化学小组做了如下实验:
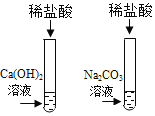
将反应后两只试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行探究。
[提出问题]滤液中溶质的成分是什么?
[假设与猜想]猜想一: NaCl
猜想二: NaCl 和CaCl2
猜想三: NaCl、Ca(OH)2 和HCl
猜想四:___________。
[讨论与交流]经讨论同学们一致认为猜想_________是错误的。原因是____________(用化学方程式解释)
[实验与结论]
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量碳酸钠溶液 | 无现象 | 猜想四成立 |
取少量滤液于试管中,滴加适量_______________ | ______________________ |
[拓展与迁移]稀盐酸和稀硫酸有相似的化学性质,是因为它们的溶液中都存在_______________。
【答案】NaCl 和Na2CO3 三 ![]() 稀盐酸或稀硫酸;氢氧化钙溶液或氢氧化钡溶液;氯化钙溶液或氯化钡溶液 有气泡产生;有白色沉淀生成;有白色沉淀生成 氢离子(或 H+)
稀盐酸或稀硫酸;氢氧化钙溶液或氢氧化钡溶液;氯化钙溶液或氯化钡溶液 有气泡产生;有白色沉淀生成;有白色沉淀生成 氢离子(或 H+)
【解析】
将反应后两只试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,是因为稀盐酸和碳酸钠反应生成了二氧化碳,后有白色沉淀出现,是因为碳酸钠和氯化钙反应生成了白色沉淀碳酸钙;
假设与猜想:
猜想一: NaCl
猜想二: NaCl 和CaCl2
猜想三: NaCl、Ca(OH)2 和HCl
猜想四:碳酸钠过量时是NaCl 和Na2CO3。
讨论与交流:
经讨论同学们一致认为猜想三是错误的,原因是氢氧化钙和盐酸反应生成氯化钙和水,即盐酸和氢氧化钙不能共存,反应的化学方程式:![]() 。
。
实验与结论:
取少量滤液于试管中,滴加适量碳酸钠溶液,无明显现象,说明溶液中不含有盐酸;
取少量滤液于试管中,滴加适量稀盐酸,产生气泡,是因为盐酸和碳酸钠反应生成了二氧化碳,即猜想四成立。
故填:稀盐酸;产生气泡。
拓展与迁移:
稀盐酸和稀硫酸有相似的化学性质,是因为它们的溶液中都存在氢离子。