题目内容
【题目】学习小组对碱式碳酸铜[化学式为![]() ]的性质进行探究,并进行相关实验。
]的性质进行探究,并进行相关实验。
①分析组成
碱式碳酸铜中化合价为-1价的原子团是___________。
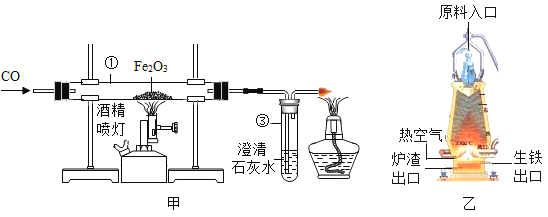
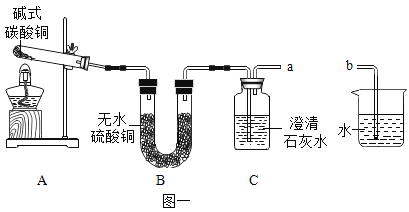
②探究分解产物,装置如图一所示(省略夹持仪器)
实验步骤 | 现象 | 分析和结论 |
Ⅰ.组装装置,连接导管a、b,微热试管。 | 烧杯中的导管口_________。 | 说明整套装置不漏气。 |
Ⅱ.加入药品和试剂,点燃酒精灯。 | A中固体出现黑色,B中白色固体变蓝,C中石灰水变浑浊。 | C中反应的化学方程式为_________。碱式碳酸铜受热分解的产物有 |
③用氢气还原装置A中反应后的固体并检验产物,装置如图二所示(F中的无水硫酸铜用于吸收空气中的水蒸气)
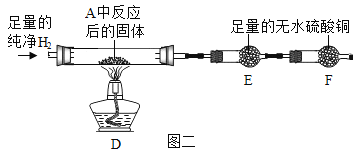
Ⅰ.D中观察到固体变红。
Ⅱ.实验开始时,若先点燃酒精灯后通氢气,可能导致的后果是______________。
Ⅲ.E中观察到白色固体变蓝,发生反应的化学方程式为______________,该现象能否证明氢气和氧化铜反应生成了水,理由是______________。
④学习小组还利用图二装置定量测定水的组成(玻璃管中为纯净氧化铜),并测定了下表的四个数据(单位:g)。
反应前质量 | 反应后质量 | |
装置D | a | b |
装置E | c | d |
利用表格中数据,列式表示水中氢、氧原子的物质的量之比______________。(不要求化简)
【答案】氢氧根 气泡产生 ![]()
![]() 氢气与空气混合受热爆炸
氢气与空气混合受热爆炸 ![]() 不能,A中反应后的固体中有未完全分解的
不能,A中反应后的固体中有未完全分解的![]() ,也会在D中受热分解产生
,也会在D中受热分解产生![]()
![]()
【解析】
①分析组成
碱式碳酸铜中铜元素显+2价,氢氧根显-1价,碳酸根显-2价,因此化合价为-1价的原子团是氢氧根。
②探究分解产物,装置如图一所示:
步骤I:检查装置的气密性,组装装置,连接导管a、b,微热试管,观察到烧杯中的导管口有气泡产生,说明整套装置不漏气;
步骤Ⅱ:加热分解碱式碳酸铜,并检验其分解的产物,A为发生装置,B中无水硫酸铜检验水,C中澄清石灰水检验二氧化碳;加入药品和试剂,点燃酒精灯,观察到A中固体出现黑色,B中白色固体变蓝,C中石灰水变浑浊;说明碱式碳酸铜受热分解生成了氧化铜、水和二氧化碳;C中二氧化碳使石灰水变浑浊,二氧化碳和氢氧化钙反应生成了碳酸钙和水,反应的化学方程式为![]() ;
;
③用氢气还原装置A中反应后的固体并检验产物,装置如图二所示,D为氢气与固体的反应装置,E为检验水的装置,已知F中的无水硫酸铜用于吸收空气中的水蒸气:
Ⅰ、D中观察到固体变红。
Ⅱ、实验开始时,因为装置中有空气,若先点燃酒精灯后通氢气,可能导致氢气与空气混合受热爆炸。
Ⅲ、E中观察到白色固体变蓝,硫酸铜与水反应生成了五水硫酸铜,反应的化学方程式为![]() ,该现象不能证明氢气和氧化铜反应生成了水,因为A中反应后的固体可能有未完全分解的
,该现象不能证明氢气和氧化铜反应生成了水,因为A中反应后的固体可能有未完全分解的![]() ,也会在D受热分解产生
,也会在D受热分解产生![]() 。
。
④学习小组利用图二装置定量测定水的组成,已知玻璃管中为纯净氧化铜,D中反应为氢气与氧化铜在加热条件下生成水和铜,E装置吸收生成的水,测得反应前装置D的质量为ag,反应后装置D的质量为bg,即氧元素的质量为(a-b)g,反应前装置E的质量为cg,反应后装置E的质量为dg,即水的质量为(d-c)g,则氢元素的质量为(d-c-a+b)g,
氧原子的摩尔质量为16g/mol,氢原子的摩尔质量为1g/mol,那么水中氢、氧原子的物质的量之比为 。
。

 名校课堂系列答案
名校课堂系列答案