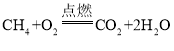题目内容
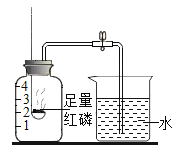
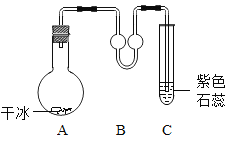
【题目】对一块含10g碳酸钙的大理石(杂质不溶于水,也不反应)按如图进行实验,有关分析错误的是( )
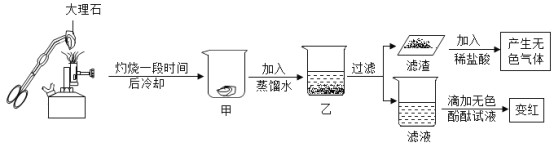
A. 甲处固体中一定含有碳酸钙B. 乙处液体中一定含有氢氧化钙
C. 产生的无色气体小于0.1molD. 滤渣是碳酸钙和杂质的混合物
【答案】D
【解析】
根据流程图中的条件分析每个步骤可能出现的情况,最后作出综合分析与判断。
根据流程图可知,第一步大理石灼烧时,碳酸钙受热分解,生成氧化钙和二氧化碳,杂质不反应,灼烧一段时间后冷却,没有信息说明碳酸钙已经完全分解,甲加入蒸馏水,固体中的氧化钙与水反应得到氢氧化钙溶液,没有注明水的用量,氧化钙是否完全反应未知,过滤后滤渣加入稀盐酸产生无色气体,已知杂质不参与反应,那么滤渣中一定有碳酸钙,滤液加入酚酞后变红,进一步证明第一步生成了氧化钙,加水后氧化钙与水反应生成了氢氧化钙;则:
A、由以上分析可知,甲处固体中一定含有碳酸钙,A选项正确,不符合题意;
B、乙处液体中一定含有氢氧化钙,B选项正确,不符合题意;
C、假设产生的气体等于0.1mol,已知该气体为二氧化碳气体,根据方程式
![]() 可知,二氧化碳的物质的量与参与反应的碳酸钙的物质的量相等,则滤渣中碳酸钙的物质的量为0.1mol,质量为
可知,二氧化碳的物质的量与参与反应的碳酸钙的物质的量相等,则滤渣中碳酸钙的物质的量为0.1mol,质量为![]() ,又已知原大理石质量为10g,且含有杂质,灼烧时碳酸钙又会分解一部分,滤渣中碳酸钙的质量是小于10g的,因此上述假设不成立,且产生的气体小于0.1mol,C选项正确,不符合题意;
,又已知原大理石质量为10g,且含有杂质,灼烧时碳酸钙又会分解一部分,滤渣中碳酸钙的质量是小于10g的,因此上述假设不成立,且产生的气体小于0.1mol,C选项正确,不符合题意;
D、滤渣加入稀盐酸产生无色气体说明滤渣中含有碳酸钙,而且杂质不参与反应,则滤渣中一定含有杂质,由于不知道甲到乙溶液加入水的量,不知道氧化钙是否完全反应,且滤渣的检验加入稀盐酸的现象也不能说明是否含有氧化钙,因此滤渣的成分中可能含有氧化钙,D选项错误,符合题意。故选D。

【题目】学习小组对碱式碳酸铜[化学式为![]() ]的性质进行探究,并进行相关实验。
]的性质进行探究,并进行相关实验。
①分析组成
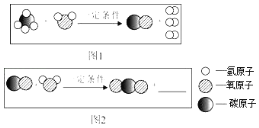
碱式碳酸铜中化合价为-1价的原子团是___________。
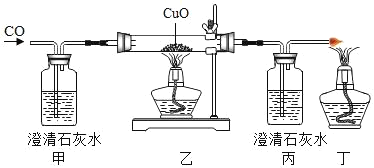
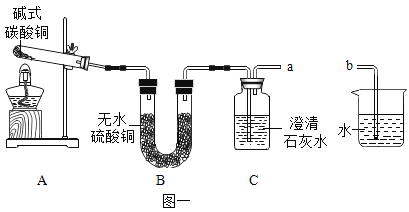
②探究分解产物,装置如图一所示(省略夹持仪器)
实验步骤 | 现象 | 分析和结论 |
Ⅰ.组装装置,连接导管a、b,微热试管。 | 烧杯中的导管口_________。 | 说明整套装置不漏气。 |
Ⅱ.加入药品和试剂,点燃酒精灯。 | A中固体出现黑色,B中白色固体变蓝,C中石灰水变浑浊。 | C中反应的化学方程式为_________。碱式碳酸铜受热分解的产物有 |
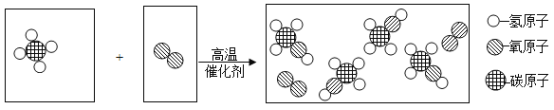
③用氢气还原装置A中反应后的固体并检验产物,装置如图二所示(F中的无水硫酸铜用于吸收空气中的水蒸气)
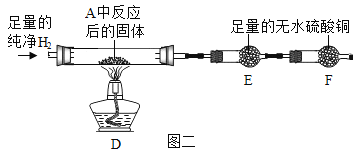
Ⅰ.D中观察到固体变红。
Ⅱ.实验开始时,若先点燃酒精灯后通氢气,可能导致的后果是______________。
Ⅲ.E中观察到白色固体变蓝,发生反应的化学方程式为______________,该现象能否证明氢气和氧化铜反应生成了水,理由是______________。
④学习小组还利用图二装置定量测定水的组成(玻璃管中为纯净氧化铜),并测定了下表的四个数据(单位:g)。
反应前质量 | 反应后质量 | |
装置D | a | b |
装置E | c | d |
利用表格中数据,列式表示水中氢、氧原子的物质的量之比______________。(不要求化简)